– Anwendung elektrochemischer Messverfahren Teil 4
Redox-Verfahren können für die Untersuchung von Neurotransmitter durch die Herstellung von Mikrosystemen mit Hilfe der Chiptechniken verwendet werden. Hierfür kommen die Strukturierungsverfahren zum Einsatz, wie sie von der Herstellung von Mikrosystemkomponenten, zum Beispiel von Lab-on-a-Chip, Anwendung finden. Damit wurden Elektrodensysteme gefertigt, mit denen sich geringste Mengen an Neurotransmittern bis hin zu einzelnen Molekülen erfassen lassen. Die Systeme eignen sich zum Messung an lebenden Organismen. Spezielle Mikrodialyseverfahren können ebenfalls zur Analyse von Neurotransmittermolekülen verwendet werden, wobei hier ebenfalls auf die bewährten Mikrosystemtechnologien zurückgegriffen wird.
In-Vivo Neurotransmitter Detection Using Electrochemical Measurement TechniquesPart 4
Redox processes can be used for investigations of neurotransmitters using micro systems based on electronic chip technology. This involves surface patterning processes analogous to those used in micro-system components, for example in Lab-on-a-Chip. For this purpose, electrodes were formed, allowing the very smallest amount of neurotransmitters to be detected, in some cases as small as an individual molecule. Such systems are ideally suited to studies of living organisms. Specially-developed micro-dialysis processes can also be used for analysis of neurotransmitter molecules, as will be described in terms of proven microsystem technologies.
–Fortsetzung aus WOMag 04/2016–
3.2.5 Redox-Cycling
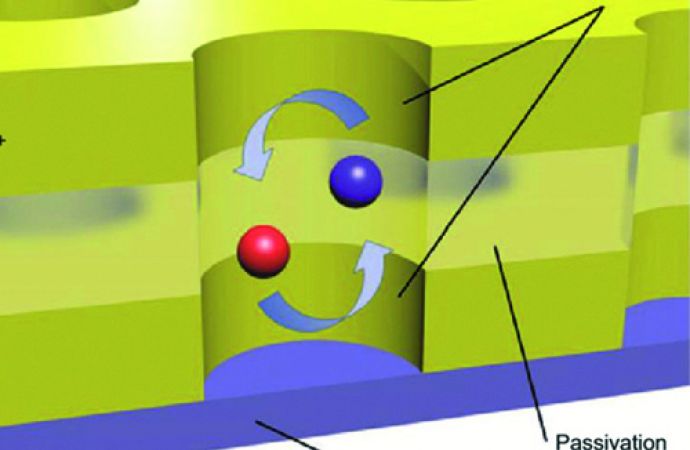
Für die Technologie des Redox-Cyclings kommen mehrere Elektroden zur Anwendung. Zwei Arbeitselektroden werden in nächster Nähe zueinander platziert. An diese werden Elektroden unterschiedlicher Spannungen angelegt: eine mit einer Spannung über und die andere mit einer Spannung unter dem Redoxpotential des jeweiligen, zu bestimmenden Redoxpaares. Dadurch werden an der einen Elektrode Substanzen oxidiert und an der anderen andere reduziert. Es entsteht ein Redoxreaktionskreislauf mit einer Ladungszone zwischen den beiden Arbeitselektroden (Abb. 38) [29]. Mit dieser Technik wird eine verbesserte Selektivität und Sensitivität von elektrochemischen Sensoren erreicht [13].

Abb. 38: Darstellung des Redox-Cycling-Mechanismus mit Elektroden für die Oxidation, Reduktion sowie einer Referenzelektrode; zwischen den beiden Arbeitselektroden unterliegen Moleküle einer Redox-Reaktion [13]
Beim Redox-Cycling sind zwei Parameter zu beachten: der Abstand der beiden Elektroden (h) und die Diffusionszeit von einer Elektrode zur anderen mit ihrer entsprechenden Diffusionskonstante (D). Aus diesen Parametern ergibt sich eine eindimensionale Diffusionsgleichung für die Durchschnittszeit TS, die ein Molekül benötigt, um von einer Elektrode zur anderen zu gelangen:
TS = h2 / 2D
Die Ladungszone zwischen den beiden Elektroden wird durch den Stromfluss zwischen den Elektroden bestimmt [13]. Der Stromfluss Icycl ist proportional zur Konzentration der zu ermittelnden Moleküle [29]. Für die Ladungszone ist die Anzahl der Elementarladungen e0 entscheidend. Aus Experimenten ergibt sich der folgende Zusammenhang:
Icycl = ne0 / 2TS = ne0D / h2
Ein Abfall der Stromstärke zwischen den Elektroden steht in Zusammenhang mit der Geometrie des umgebenden Raumes. So sind der Abstand der beiden Elektroden, die Zugänglichkeit zu den Elektroden und die Geometrie ausschlaggebend, um Aussagen über den Wirkungsgrad des Gesamtsystems zu treffen. Entscheidend ist der Zugang der umgebenden Masse in den Diffusionsraum. Je leichter die Masse in den Zwischenraum diffundieren kann, desto schneller können Konzentrationsschwankungen des Analysemoleküls erfasst werden. Je besser der Zugang ist, desto öfter werden die Moleküle zwischen den Elektroden ausgetauscht. Dabei bleibt aber die Gesamtanzahl der Redox-Zyklen gleich, die einzelnen Moleküle führen aber geringere Anzahl an Redox-Zyklen durch.
Die mehrfachen Redox-Zyklus-Reaktionen einzelner Moleküle sind in manchen Fällen allerdings erwünscht. Zum Beispiel, wenn Dopamin in Gegenwart von Ascorbinsäure genauer untersucht werden soll, denn Dopamin führt mehrfach Redox-Reaktionen durch, Ascorbinsäure jedoch nicht [13].
Beim Redox-Cycling wird zwischen der Off-Chip und der On-Chip-Technik unterschieden. Dabei basiert die On-Chip-Technik auf der Off-Chip-Technik. Sie wurde während der 1980iger Jahre erstmalig genauer untersucht [13].
Die Off-Chip-Technik arbeitet mit einer oder mehreren Arbeitselektroden, die einzeln in das Zielgebiet eingeführt werden. Ein Beispiel ist die Scanning Electrochemical Microscopy (SECM). Sie benötigt lediglich eine Mikroelektrode. Die Redox-Zyklus-Reaktionen finden hier zwischen der Elektrodenspitze und dem Substrat der Umgebung statt. Mit dieser Methode können Flächen auf ihre Topographie und chemische Reaktivität untersucht und somit ihre Oberflächenstruktur aufgezeichnet werden [13].
Die On-Chip-Techniken arbeiten gewöhnlich mit zwei Elektroden, die wie oben aufgeführt mit unterschiedlichen Spannungen angesteuert werden. Die Elektroden befinden sich im Gegensatz zur Off-Chip-Technik auf einem sogenannten Chip als gemeinsames System.
Eine Technik, die heute oft für On-Chip-Sensoren genutzt wird, ist der Interdigitated Array Sensor (IDA). Dieser Sensor besteht aus zwei in einer Ebene liegenden Elektroden mit einer kammartigen Form. Die Elektroden greifen ineinander und sind zu diesem Zweck aus einem nichtreaktiven Metall aufgebaut mit einem sehr kleinen Abstand zueinander, der im Nano- bis Mikrometerbereich liegt (Abb. 39) [13].

Abb. 39: Interdigitated Array Sensor, bei dem die beiden Elektroden mit unterschiedlichen Spannungen polarisiert werden, sodass zwischen den Elektroden das Redox-Cycling stattfinden kann [13]
Interdigitated Array-Sensoren und das Redox-Cycling werden sowohl bei amperometrischen Techniken als auch bei der Zyklischen Voltammetrie verwendet. Bei den amperometrischen Techniken werden die beiden Arbeitselektroden mit unterschiedlichen Spannungen über und unter dem Redoxpotential polarisiert, um das Redox-Cycling zwischen den Elektroden zu ermöglichen. Der Stromfluss zwischen den Elektroden wird gemessen und ausgewertet. Damit sind Aussagen über die Stoffkonzentrationen im Zwischenraum möglich. Bei der Zyklischen Voltammetrie bleibt eine Elektrode auf einem Potential über oder unter dem Redoxpotential polarisiert, während die andere zwischen einem oxidierenden und reduzierenden Potential wechselt. Die Messung wird an der konstant bleibenden Elektrode durchgeführt und in Voltammogrammen aufgezeichnet. Die Voltammogramme sind durch das Pendeln der reaktiven Moleküle zwischen den Elektroden eingeschränkt, jedoch nicht durch die Diffusion der Moleküle aus der Elektrodenumgebung, wie es bei den meisten anderen On-Chip-Techniken der Fall ist.
Die Verwendung des Interdigitated Array Sensors in Kombination mit dem Redox-Cycling wird durch den zeitlichen Aspekt der einzelnen Redox-Reaktionen, den Elektrodenabstand und die Elektrodenart beeinflusst. Durch durch den Einsatz von Nanoelektroden wären Messungen mit höherer Sensitivität möglich, jedoch korreliert dies mit einer komplexeren Produktion und schlechteren Stabilitäten der kleineren Strukturen. Durch eine Abstandverkleinerung der Elektroden auf 30 nm oder durch eine Verringerung der Abstände zwischen den Elektrodenkämmen auf 4 nm, kann eine Leistungsverbesserung aufgezeichnet werden [13].
Eine weitere Anwendung des On-Chip Redox-Cycling ist der Pore-Based Approach. Bei dieser Technik sind die Elektroden parallel zueinander und zum Chip ausgerichtet. Der Sensor besteht aus zwei oder mehreren Elektroden, die durch Isolationsschichten voneinander getrennt sind (Abb. 40). Die Isolationsschichten sind von geringer Dicke, wodurch der Elektrodenabstand klein gehalten werden kann und größere Verstärkungen, trotz der kleineren Elektrodenoberfläche, zustande kommen. Durch die Isolationsschicht wird eine individuelle Polarisierung der einzelnen Elektroden ermöglicht. Das Diffundieren der Moleküle zwischen die Elektrodenschichten erfolgt mithilfe von Porenöffnungen, deren Durchmesser in der Regel zwischen 330 nm und 650 nm liegt [13].

Abb. 40: Pore-Based Redox-Cycling-Sensor mit zwei Elektroden auf einem Wafer und einer Isolierschicht [13]
Eine weitere On-Chip-Technik ist die Nanocavity Device-Technik, bei der im Vergleich zu den anderen Redox-Cycling-Verfahren die verwendeten Sensoren die kleinsten Abmessungen aufweisen. Der einzelne Sensor enthält eine seitlich ausgerichtete Knopfelektrode mit 1 µm Durchmesser. Bei der Herstellung des Sensors wird zunächst eine Elektrode auf der Waferoberfläche platziert und eine Chromschicht aufgetragen. Anschließend wird eine zweite Elektrode aufgebracht und schließlich eine Isolierschicht, zum Beispiel aus SiO2/Si3N4. Nun wird eine kleine Öffnung in die Isolierungsschicht geätzt, um einen Flüssigkeitszugang zur Chromschicht zu ermöglichen. Diese Schicht wird durch anisotropes Ätzen entfernt, um eine Lücke als Abstand zwischen den beiden Elektroden herzustellen. Der interne Elektrodenabstand wird durch die Dicke der entfernten Schicht definiert. Im Einsatz werden die Elektroden individuell für das Redox-Cycling polarisiert. Das Diffundieren der Moleküle in den Zwischenraum geschieht durch die Öffnung in der Isolierschicht, die durch das Entfernen der Chromschicht entstanden ist (Abb. 41).

Abb. 41: Herstellungsprozesses eines Nanocavity Redox-Cycling-Sensors durch Aufbringen der ersten Elektrode (A), der Chromschicht (B), der zweiten Elektrode (C) und der Isolierschicht nach der anisotropen Ätzung (D); der fertige Sensor liegt nach Entfernen der Chromschicht (E) vor [13]
Mit der Nanocavity Device-Technik können unter Anwendung von hohen Signalverstärkungen, geringsten Elektrodenabständen und großen Redox-Cycling Oberflächenmessungen von einzelnen Molekülen durchgeführt werden. Dabei trägt jedes Molekül etwa 78 fA zum Gesamtstromfluss bei [13].
3.3 Mikrodialyse
Die Mikrodialyse, erstmals vor mehr als 30 Jahren entwickelt, unterscheidet sich stark von den elektrochemischen Techniken, da hier Proben entnommen und ex vivo analysiert werden. Sie ermöglicht lokale Untersuchungen von Stoffkonzentrationen in den unterschiedlichsten Geweben. Neurochemische Analysen von Neurotransmittern, aber auch von Stoffwechselprodukten, Biomarkern sowie Chemotherapie-Medikamenten können durchgeführt werden. Das zerebrale Mikrodialysesystem besteht aus einem stereotaktischen Apparat, einer Messsonde, einer Pumpe und Phiolen, in denen das Perfusat gesammelt wird. Für bestimmte Anwendungen wurden bereits tragbare Pumpen zur fortdauernden Anwendung entwickelt, mit denen sich die Patienten frei bewegen können. Außerdem wird das System entweder an einen automatischen Analysator oder an eine Online-Analyse angeschlossen. Durch eine Führungskanüle wird eine dünne Dialysesonde in das relevante Gewebe eingeführt und mit physiologischer Flüssigkeit durchspült. Die Sondenspitze besteht aus einer semipermeablen Dialysemembran, über die dem Gewebe kontinuierlich Stoffe entzogen oder zugeführt werden können (Abb. 42). In normalem Hirngewebe ist diese Membran circa 10 mm lang. Die Flüssigkeit fließt mit einer geringen Fließgeschwindigkeit von 1 µl/min bis 10 µl/min durch die Sonde. Das Perfusat hat eine bestimmte Zusammensetzung, die der Umgebung der Sonde ähneln muss. Meist handelt es sich dabei um künstliche Hirn-Rückenmarksflüssigkeit oder eine Ringer-Lösung. Sind Moleküle der Extrazellulären Flüssigkeit nicht im Perfusat vorhanden, entsteht ein Konzentrationsgradient zwischen Interstitium und Sonde. Aufgrund dessen diffundieren sie durch die Membran und werden im Anschluss in das Analysensystem geleitet. Wenn nötig, könne Stoffe außerdem mit dem selben Mechanismus im Gewebe freigesetzt werden. Die Porengröße der Membran liegt gewöhnlich im Bereich von 6 kDa bis 100 kDa. Da Zellen und Makromoleküle diese Membranen nicht durchdringen können, muss vor der Analyse der Proben keine Zentrifugation oder Proteinabscheidung durchgeführt werden.

Abb. 42: Mikrodialysesonde [30]
In festgelegten Intervallen werden so Proben entnommen und ex vivo mit verschiedenen chemischen Analysen untersucht. Bei der Offline-Analyse werden die Proben in Phiolen gefüllt und mit einer zeitlichen Auflösung von fünf Minuten bis zehn Minuten ausgewertet. Die Online-Analyse besitzt demgegenüber einige Vorteile. Sie basiert auf analytischen Abscheidungsmethoden und liefert daher unmittelbare Rückmeldungen über den Behandlungserfolg parallel zur Durchführung. Die zeitliche Auflösung liegt hier unter einer Minute, was Probleme beim Flüssigkeitstransport sowie der Aufbewahrung verhindert. Zusätzlich reichen bereits Proben im Nanoliterbereich aus, um ein zufriedenstellendes Ergebnis zu erzielen. Da das Dialysat kaum der Luft ausgesetzt wird, wird der Abbau von unstabilen Substanzen verhindert. Somit sind die Probenvorbereitungen weniger umfangreich und eine automatisierte Analyse unkomplizierter. Insgesamt liefert die Online-Auswertung eine größere Informationsausbeute für eine bessere Vergleichbarkeit der Messungen [31].
Soll eine quantitative Bestimmung erzielt werden, muss das Messsystem kalibriert werden. Da die Sonde ständig mit Perfusat durchspült wird, stellt sich an der Membran nie ein Gleichgewicht ein. Aufgrund dessen wird das Verhältnis (RR) zwischen der Konzentration im Dialysat (Cd) und der extrazellulären Flüssigkeit (Ce) bestimmt und in der Regel in Prozent angegeben.
Die Mikrodialyse eignet sich vor allem zur Bestimmung von hydrophilen Neurotransmittern mit hohem Verhältnis RR wie Acetylcholin, Dopamin und Glutamat, sowie Adenosin. Da größere Moleküle ein geringes Verhältnis aufweisen, können diese schlechter nachgewiesen werden.
Bei der Mikrodialyse werden vier Sondentechniken unterschieden: Die Verwendung der linearen Sonde, Loop-Sonde, Side-by-Side-Sonde und der konzentrischen Sonde. Bis auf die letzte Methode führen alle zu starken Gehirnschäden und einer langen Ausheilungszeit. Nur bei der konzentrischen Sonde ist beides von geringem Ausmaß. Die lineare Sonde kann für transzerebrale Messungen verwendet werden, allerdings kein spezifisches Hirngewebe identifizieren. Für oberflächliches Hirngewebe wird die Loop- oder die Side-by-Side-Sonde genutzt, während die konzentrische Sonde ausgeprägte dreidimensionale Strukturen in tiefliegendem Hirngewebe erkennt. Ein großer Vorteil der Mikrodialyse ist die Möglichkeit, sie auch bei Patienten mit minimaler Blutversorgung, wie Kindern und Neugeborenen, durchführen zu können. Allerdings gibt es relativ wenige Patienten, für die eine Behandlung durch Mikrodialyse in Frage kommt. Daher ist es schwierig, ausreichend Kandidaten für klinische Studien zu finden, wodurch meist nur kleine Beobachtungsstudien oder eingeschränkte klinische Studien realisierbar sind.
In der praktischen Durchführung der Mikrodialyse können äußere Bedingungen die Ergebnisse beeinflussen. Bei der Implantation der Sonde kommt es zu einer Schädigung des Hirngewebes, sowie nach einigen Tagen zu Fibrose oder Gliose. Auch das Immunsystem reagiert auf den Fremdkörper. Somit muss vor der Kalibrierung eine angemessene Zeit abgewartet werden, um brauchbare Ergebnisse zu erzielen. Dazu kommt das Problem, dass die kontinuierliche Messung in der Realität meist nicht machbar ist, da die Messungen oft durch andere medizinische Untersuchungen unterbrochen werden müssen. Auch kommt es gelegentlich zu Fehlfunktionen der Pumpen oder der Katheter [31].
Im Vergleich zu den elektrochemischen Methoden ist die Mikrodialyse in Bezug auf die Selektivität und Sensitivität gleichauf oder sogar besser. Allerdings sind die Mikrodialysen-Sonden größer als die Elektroden und richten mehr Schäden im Gewebe an. Außerdem wird deutlich mehr Zeit benötigt, um die Messergebnisse zu sammeln, was das Erfassen von sekundenschnellen Konzentrationsänderungen kaum möglich macht [6].
4 Anwendung in vivo
Die vorgestellten Techniken kommen am lebenden Organismus in verschiedenen Systemen zum Einsatz, die für spezielle Anwendungsbereiche entwickelt wurden. Beispielhaft werden Closed-Loop-System, der Wireless Instantaneous Neurochemical Concentration-Sensor (WINCS) und Systeme der Mikrodialyse vorgestellt.
4.1 Closed-Loop-Systeme
Bei den behandelten Detektionsmethoden handelt es sich um so genannte Open-Loop-Techniken. Das heißt, sie werden vor dem Implantieren auf die gewünschten Signale programmiert. Es ist nicht möglich, die Parameter entsprechend des unvorhersehbaren Verlaufs einer Krankheit anzupassen. Vielmehr müssen die Stimu-
lationseinstellungen in einem zeitraubenden Prozess regelmäßig neu angeglichen werden. Abhilfe schaffen Closed-Loop-Systeme. Sie bestehen aus einer Stimulationselektrode und einer detektierenden Elektrode oder idealerweise aus einer Elektrode, die beide Funktionen parallel ausführt. Die erfassten Daten werden online ausgewertet. Das System reagiert auf Konzentrationsänderungen automatisch mit einer entsprechenden Stimulation.
Aktuell werden Tierversuche sowohl zur Therapie von Epilepsie, als auch zur Behandlung von Parkinson mit Closed-Loop-Systemen durchgeführt, bei denen zum Beispiel die Ergebnisse von verschiedenen angezielten Gehirnregionen verglichen werden [11, 32].
Das Unternehmen NeuroPace führt zur Zeit eine klinische Studie mit ihrem Closed-Loop-System RNS® durch [33].
4.2 WINCS
Wireless Instantaneous Neurochemical Concentration-Sensor (WINCS) wurde an der Mayo Clinic (Rochester, Minnesota) zur Messung von extrazellulären Neurotransmitterkonzentrationen am Menschen entwickelt. Für die Messungen werden entweder FSCV oder FPA eingesetzt und damit die erfassten Daten grafisch fast zeitgleich ausgewertet. Üblicherweise wird eine Karbonfaser-Mikroelektrode verwendet. Das System besteht aus einem batteriebetriebenen Patientenmodul und einer speziellen Software (WINCSware), die auf einem nahegelegenen Computer installiert ist. Das Patientenmodul erzeugt die benötigten Potentiale. Die erfassten Daten werden mit einer Abtastrate von etwa 100 Kilosamples pro Sekunde abgefragt und von einem Transimpedanzverstärker digitalisiert. Schließlich werden sie per Bluetooth (2,4–2,5 GHz) an die Basisstation gesendet.
Mit der WINCSware werden die FSCV- oder FPA-Parameter eingestellt und die übertragenen Daten aufgezeichnet. Diese können in verschiedenen Formaten grafisch dargestellt und auch nachträglich offline analysiert werden [6, 21, 34]. Hauptsächlich wird WINCS zum Nachweisen der Neurotransmitter Dopamin, Glutamat und Adenosin verwendet [11, 24]. Das System liefert zufriedenstellende Ergebnisse bei vielen Experimenten, auch unter dem Einfluss von anderen elektromagnetischen Signalen, die in neurochirurgischen Operationsräumen auftreten können [24].
4.3 Mikrodialyse
Derzeit wird an der Zhejiang Universität ein spezieller Aufbau für die Langzeit-Mikrodialyse getestet. Er kann mit konzentrischen und linearen Kathetern betrieben werden. Sowohl die Anwendung des Systems, als auch alle nötigen Maßnahmen haben sich als realisierbar erwiesen. Das System ist leicht anwendbar, hat einen geringen Materialverbrauch und schränkt die Patienten in Bezug auf ihre Mobilität kaum ein. In einer Studie konnten zufriedenstellende Daten über eine Gesamtdauer von circa 87 Stunden erfasst werden [31].
5 Zusammenfassung
Der Überblick über die elektrochemischen Verfahren zeigt, dass in den letzten Jahren große Fortschritte in dem weiten Bereich der Neurotransmitterdetektion erzielt wurden. Sowohl die Sensitivität als auch die Selektivität der Methoden haben sich stark verbessert. Vor diesem Hintergrund konnten viele neue Erkenntnisse über die Neurotransmitter und deren Transportvorgänge im Gehirn erlangt werden, womit wiederum neue Detektionsmethoden entwickelt und alte verbessert wurden. Zum Beispiel stellte sich heraus, dass einige Techniken in bisher nicht beachteten Gehirnregionen bessere Ergebnisse erzielen. Besonders FSCV und FPA erlangten zufriedenstellende Ergebnisse in Tierversuchen und klinischen Studien und gehören heute zu den gebräuchlichsten Techniken. Währenddessen eignen sich andere Techniken nur für sehr spezielle Messungen oder können, was Selektivität und Sensitivität betrifft, nicht mehr mithalten.
In Zukunft sind jedoch noch viele Hindernisse zu überwinden. Vor allem der Übergang von Tier- auf Humanversuche ist eine wichtige Schwelle, die bis jetzt noch kaum überschritten wird. Vielversprechende Systeme zur Therapie von neurologischen Krankheiten wurden aber bereits entwickelt und können hoffentlich in den nächsten Jahren in Umlauf gebracht werden. Alles in allem, ist es wichtig, die Forschung im Bereich der Neurotransmitterdetektion weiterzuführen, da sie essentiell für die Therapie von neurologischen Krankheiten ist. Natürlich muss die Neurochirurgie weiterhin mit Vorsicht betrachtet werden, denn bereits kleinste Komplikationen können gravierende Folgen mit sich bringen. Sind die Methoden aber ausführlich getestet und fehlerfrei durchführbar, ermöglichen sie den betroffenen Patienten eine enorme Verbesserung ihrer Lebensqualität.
Literatur
[6] Van Gompel, Jamie J, S.-Y. Chang, S. J. Goerss, I. Y. Kim, C. Kimble, K. E. Bennet, K. H. Lee: Development of intraoperative electrochemical detection: wireless instantaneous neurochemical concentration sensor for deep brain stimulation feedback; Neurosurg Focus, vol. 2, no. 29, pp. E6, http://www.ncbi.nlm.nih.gov/pubmed/20672923, 2010
[11] K. H. Lee, C. D. Blaha, P. A. Garris, P. Mohseni, A. E. Horne, K. E. Bennet, F. Agnesi, J. M. Bledsoe, D. B. Lester, C. Kimble, H.-K. Min, Y.-B. Kim, Z.-H. Cho: Evolution of Deep Brain Stimulation: Human Electrometer and Smart Devices Supporting the Next Generation of Therapy; (en), Neuromodulation, vol. 2, no. 12, pp. 85–103, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2908254/, 2009
[13] E. Kätelhön, B. Wolfrum: On-chip redox cycling techniques for electrochemical detection; (en), Reviews in Analytical Chemistry, pp. 7–14, http://www.degruyter.com/view/j/revac.2012.31.issue-1/revac-2011-0031/
revac-2011-0031.xml, 2012
[21] Do Hyoung Kim, Yoonbae Oh, Hojin Shin, Charles D. Blaha, Kevin E. Bennet, Kendall H. Lee, In Young Kim, Dong Pyo Jang: Investigation of the reduction process of dopamine using paired pulse voltammetry; (en), Journal of Electroanalytical Chemistry, no. 717-718, pp. 157–164, http://www.sciencedirect.com/science/article/pii/S1572665714000277#, 2014
[24] J. M. Bledsoe, C. J. Kimble, D. P. Covey, C. D. Blaha, F. Agnesi, P. Mohseni, S. Whitlock, D. M. Johnson, A. Horne, K. E. Bennet, K. H. Lee, P. A. Garris: Wireless Instantaneous Neurotransmitter Concentration System – based amperometric detection of dopamine, adenosine, and glutamate for intraoperative neurochemical monitoring; (en), Journal of Neurosurgery, vol. 4, no. 111, pp. 712–723, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2808191/, 2009
[29] E. Kätelhön, B. Hofmann, M. Banzet, A. Offenhäusser, B. Wolfrum: Time-resolved mapping of neurotransmitter fluctuations by arrays of nanocavity redox-cycling sensors; Eurosensor XXIV Conference, vol. 5, no. 0, pp. 956–958, http://www.sciencedirect.com/science/
article/pii/S1877705810008143, 2010
[30] Wikipedia: Schematic illustration of a microdialysis probe; available: http://upload.
wikimedia.org/wikipedia/en/3/3a/Schematic_illustration_of_a_microdialysis_probe.png (2014, Aug. 16)
[31] L. Liu, X. Zhang, Y. Lou, Y. Rao, X. Zhang: Cerebral microdialysis in glioma studies, from
theory to application; (en), Journal of Pharmaceutical and Biomedical Analysis, vol. 96, pp. 77–89, http://ac.els-cdn.com/S0731708514001538/
1-s2.0-S0731708514001538-main.pdf?_tid=93c30490-1d75-11e4-9815-00000aab0f26&acdnat=1407335335_8f236ec5bb8b9027966c23631f0721ea, 2014
[32] A. Beuter, J.-P. Lefaucheur, J. Modolo: Closed-loop cortical neuromodulation in Parkinson’s disease: An alternative to deep brain stimulation?; (en), Clinical Neurophysiology, vol. 125, no. 5, pp. 874–885, www.sciencedirect.com/science/article/pii/S1388245714000376, 2014
[33] NeuroPace INC, NeuroPace: RNS® System; available: www.neuropace.com/about/
overview.html (2014, Aug. 18)
[34] C. J. Kimble, D. M. Johnson, B. A. Winter, S. V. Whitlock, K. R. Kressin, A. E. Horne, J. C. Robinson, J. M. Bledsoe, S. J. Tye, Su-Youne Chang, F. Agnesi, C. J. Griessenauer, D. Covey, Young-Min Shon, K. E. Bennet, P. A. Garris, K. H. Lee: Wireless instantaneous neurotransmitter concentration sensing system (WINCS) for intraoperative neurochemical monitoring; Conf Proc IEEE Eng Med Biol Soc, 2009
-Ende
DOI: 10.7395/2016/Rech04