Von Roy Morgenstern, Maximilian Sieber, Ingolf Scharf und Thomas Lampke, TU Chemnitz
Die anodische Oxidation ist ein bewährter Prozess zur Steigerung der Verschleiß- und Korrosionsbeständigkeit von Aluminiumlegierungen. Im Vergleich zu Reinaluminium werden für aushärtbare Aluminium-Kupferlegierungen jedoch geringere Stromausbeuten und Schichthärten erreicht. Die vorliegende Arbeit erklärt zunächst die Ursache für die beeinträchtigte Anodisierbarkeit dieser Legierungen und bewertet die Eignung von Salpetersäure als Zusatz zur Verbesserung der Schichteigenschaften sowie der Wirtschaftlichkeit des Prozesses. Als Grundlage für die Experimente dienen die Legierung AlCu4Mg1 sowie ein schwefelsaurer Elektrolyt. Unter den Bedingungen des Hartanodisierens wird die Wirkungsweise von Salpetersäure sowie Oxalsäure (als typisches organisches Additiv) im Rahmen eines vollfaktoriellen Versuchplans vergleichend untersucht. Der Zusammenhang zwischen den Additivkonzentrationen und Prozesskenngrößen (z. B. Energieeffizienz) sowie Schichteigenschaften wird mithilfe eines Polynoms beschrieben und mittels Varianzanalyse auf Signifikanz überprüft. Zudem wird die Ausbildung mikroskaliger Fehlstellen in der Oxidschicht mittels Rasterelektronenmikroskopie und Grauwertkorrelation quantifiziert und mittels Ritztest hinsichtlich ihres Einflusses auf die Abriebbeständigkeit untersucht.
Impact of additives on the anodization of aluminum-copper alloys
The anodic oxidation process is an established means for the improvement of the wear and corrosion resistance of aluminum alloys. However, in comparison with commercially unalloyed aluminum, lower current-efficiencies and coating hardness are achieved for age-hardenable aluminum-copper alloys. This article initially explains the reasons for the impaired anodizability and evaluates the suitability of nitric acid as an additive to improve the coating properties and the economic efficiency of the process. The experiments are conducted in a sulfuric acid base-electrolyte on alloy AlCu4Mg1. The mechanistic effects of nitric acid and oxalic acid (being a common organic additive) additives are discovered under the conditions of hard anodizing using a full-factorial design of experiments. The correlation between additive concentrations and both process characteristics (e.g. energy efficiency) and coating properties is described by a polynomial function and the significance of the results is assessed by an analysis of variance. Additionally, electron microscopy and grey-scale analysis are combined to quantify the amount of microscale imperfections within the oxide layer and scratch testing is applied to characterize their impact on the abrasion resistance.
1 Einleitung
Die anodische Oxidation ist ein weit verbreitetes Verfahren zur Oberflächenveredlung von Aluminium und seinen Legierungen. Durch anodische Polarisation in einem sauren Elektrolyt wird eine oxidische Konversionsschicht gebildet, die das Substrat vor Korrosion und Verschleiß schützt und darüber hinaus besondere haptische und dekorative Eigenschaften sowie eine hohen elektrischen Widerstand aufweist. Die Absenkung der Elektrolyttemperatur auf höchstens 5 °C hat eine deutliche Reduzierung der chemischen Rücklösung des Oxids zur Folge. Auf diese Weise sind anodisch erzeugte Oxidschichten mit besonders geringer Porosität und besonders hoher Härte und Abriebbeständigkeit herstellbar. Dieser als Hartanodisieren bezeichnete Prozess ist jedoch kostspielig, da sowohl für den Prozess selbst (infolge der erhöhten Prozessspannung) als auch für die Elektrolytkühlung zusätzliche Energie benötigt wird.
Darüber hinaus sind nicht auf allen Aluminiumlegierungen Anodisierschichten mit gleich hoher Schichtqualität und gleicher Wirtschaftlichkeit herstellbar, da die Legierungselemente den Schichtbildungsprozess beeinflussen. Insbesondere die hochfesten, für den Leichtbau in Luft- und Raumfahrt eingesetzten Aluminium-Kupfer-Legierungen gelten als schwer anodisierbar. Dies ist auf die Besonderheiten bei der Oxidation des Kupfers zurückzuführen. Die Gibbs-Energie für die Bildung von Aluminiumoxid ist deutlich negativer als jene für Kupferoxid [1]. Aluminium wird folglich bevorzugt oxidiert und es kommt zur Anreicherung der Kupferatome am Substrat-Schicht-Interface bis zur Ausbildung der Phase Al2Cu mit Abmessungen von wenigen Nanometern [1-3]. Bei der nachfolgenden Oxidation der kupferreichen Phase entsteht ein kupferreiches Oxid, welches im Vergleich zur Al2O3-Sperrschicht einen deutlich geringeren elektrischen Widerstand aufweist. Dies ermöglicht unter anodischer Polarisation lokal die Elektrolyse des Wassers, also die Bildung von molekularem Sauerstoff. Die für diese Nebenreaktion verbrauchte elektrische Ladungsmenge steht für die Oxidbildung nicht zur Verfügung. Daraus resultiert eine geringere Stromausbeute. Zum Erreichen einer geforderten Schichtdicke (korrekter: Schichtmasse) muss also eine größere elektrische Ladungsmenge zugeführt werden. Dies hat höhere Energiekosten und gegebenenfalls längere Prozesszeiten zur Folge.
Weiterhin führt die infolge Anreicherung und Oxidation periodisch auftretende lokale Gasentwicklung zur Ausbildung von nanoskaligen Hohlräumen entlang der Porenkanäle. Daraus resultieren eine erhöhte Porosität sowie eine reduzierte Härte der anodischen Oxidschichten. Typische Porenstrukturen anodischer Oxidschichten auf AlCu4Mg1 sind in Abbildung 1 am materialografisch präparierten Querschliff (links) sowie an einer Bruchfläche (rechts) dargestellt.

Abb. 1: REM-Bilder (Topografiekontrast) der Porenstruktur nach anodischer Oxidation der Legierung AlCu4Mg1 in 20 Vol.-% Schwefelsäure am materialografisch präparierten Querschliff (links) sowie am Bruch (rechts)
Weitere Fehlstellen in der Schicht entstehen infolge der anodischen Umwandlung oder Auflösung mikroskaliger intermetallischer Phasen. Die häufig abgerundeten, ellipsoiden AlCu2Mg-Ausscheidungen (S-Phase) werden bevorzugt in schwefelsauren Lösungen aufgelöst und hinterlassen ellipsoide Hohlräume in der Schicht. Zusätzlich liegen infolge von Verunreinigungen (Eisengehalt bis zu 0,5 Gew.-%) eisenreiche Ausscheidungen mit einer Größe von über 10 μm und einer spratzigen Form im Substratgefüge vor. Die Umwandlung dieser Ausscheidungen erfolgt langsamer im Vergleich zum Aluminiummischkristall unter Bildung eines stark porösen Oxids. Beide Arten von Fehlstellen führen zu einer erhöhten Schichtporosität und einer reduzierten, integralen Schichthärte.
Das anodische Umwandlungsverhalten von Aluminiumlegierungen und die chemische Rücklösung des Oxids werden durch die Elektrolytzusammensetzung beeinflusst. Anionen organischer Verbindungen, wie zum Beispiel der Glycolsäure, Oxalsäure oder des Glyzerins, werden an den Porenwänden adsorbiert und reduzieren die chemische Rücklösung in schwefelsauren Elektrolyten [5]. Auf diese Weise erhält man auch bei erhöhten Elektrolyttemperaturen (z. B. 10 °C) harte und abriebfeste Schichten. Den Kosteneinsparungen infolge der reduzierten Kühlleistung stehen wegen der erhöhten Prozessspannung jedoch erhöhte Energiekosten für die anodische Oxidation gegenüber [6].
Aktuelle Forschungsarbeiten zeigen, dass durch Zugabe von Salpetersäure beim Hartanodisieren der Legierung AlCu4Mg1 die Prozessspannung ohne Beeinträchtigung der Schichteigenschaften (z. B. Dicke, Härte) reduziert werden kann [6]. Dem liegt offenbar gegenüber der Wirkung organischer Additive ein anderer, bisher nicht weiter erforschter Wirkmechanismus zugrunde. Die vorliegende Arbeit beschreibt den Einfluss des Additivs Salpetersäure beim Hartanodisieren in einem schwefelsauren Elektrolyt auf die Schichtmikrostruktur, die resultierenden Schichteigenschaften (Dicke, Härte, Ritzwiderstand) sowie energetische Kenngrößen wie Stromausbeute und Energieeffizienz. Auf dieser Grundlage wird die Eignung des Additivs Salpetersäure bewertet und dessen Wirkmechanismus ergründet.
2 Energieeffizienz
Das Hartanodisieren erfolgte bei einer Elektrolyttemperatur von 5 °C an Blechen der Legierung AlCu4Mg1 (EN AW-2024 T4) mit den Abmessungen 50 mm x 25 mm x 1,5 mm. Als Grundelektrolyt diente 20 Vol.-% Schwefelsäure (H2SO4); die Additivkonzentrationen betrugen 0 mol/l, 0,4 mol/l und 0,8 mol/l für Salpetersäure (HNO3) sowie 0 mol/l und 0,2 mol/l für Oxalsäure (C2H2O4). Bei konstanter Stromdichte von 3 A/dm2 ist für alle Elektrolytkompositionen zu Prozessbeginn zunächst ein kurzer Spannungsanstieg infolge der Sperrschichtbildung zu beobachten (Abb. 2). Mit einsetzender Porenbildung sinkt die Prozessspannung für den Grundelektrolyt auf etwa 23 V ab und im Verlauf des 45-minütigen Prozesses steigt die Prozessspannung nur leicht an auf bis zu 27 V.

Abb. 2: Spannungsverläufe für unterschiedliche Elektrolytzusammensetzungen bei konstanter Stromdichte von 3 A/dm2; die dünnen, helleren Linien kennzeichnen die Standardabweichungen
Für die Zugabe von Oxalsäure ist zu Prozessbeginn zunächst ein ähnlicher Spannungsverlauf zu beobachten. Nach etwa 10 min steigt die Spannung jedoch deutlich an und nach etwa 40 min wird etwa der doppelte Spannungsbetrag erreicht. Dies hat einen Anstieg der elektrischen Energie um etwa 34 % zur Folge. Eine Ursache hierfür ist, wie bereits in der Einleitung erwähnt, die Adsorption von Oxalationen an Porenwänden und Porengrund und die Behinderung der Migration von Aluminiumionen (Al3+) hin zum Elektrolyt beziehungsweise Sauerstoffionen (O2-) hin zum Substrat. Weiterhin wird die Ionendiffusion in den nach außen hin weniger stark aufgeweiteten Porenkanälen mit steigender Schichtdicke zunehmend erschwert.
Demgegenüber stellt sich für die Zugabe von 0,4 mol/l Salpetersäure zum Grundelektrolyt im frühen Stadium des Porenwachstums (nach etwa 2 min) eine deutlich geringere Spannung von etwa 18 V bis 19 V ein. Die Wirkung des Additivs setzt folglich bereits zu Beginn des Prozesses ein. Im weiteren Verlauf steigt die Prozessspannung über jene des Grundelektrolyts auf bis zu 30 V. Für eine Prozesszeit von 45 min ergibt sich eine Energieeinsparung um etwa 0,4 %. Dieser Trend wird durch Erhöhung der Salpetersäurekonzentration (HNO3) auf 0,8 mol/l noch verstärkt. Insbesondere für kurze Prozesszeiten sind durch Zugabe von Salpetersäure noch deutlich höhere Energieeinsparungen im Vergleich zum Grundelektrolyt realisierbar. Durch Zugabe von Salpetersäure zu einem Schwefelsäure-Oxalsäure-Elektrolyt wird der Spannungsverlauf hin zu tieferen Werten verschoben. Für die kombinierte Zugabe von 0,2 mol/l C2H2O4 und 0,4 mol/l HNO3 ergibt sich nur noch ein Energieanstieg um etwa 20 % (gegenüber 34 % ohne HNO3).
Zur Bewertung der Energieeffizienz erfolgte die zerstörungsfreie Bestimmung der Schichtdicke mittels Wirbelstrommessgerät sowie an einigen Proben die Bestimmung der Schichtflächenmasse durch Wiegen vor und nach Entfernung der Schicht in einer Chrom-Phosphorsäure-Lösung (35 mL/l Phosphorsäure, 20 g/l Chrom(VI)oxid bei ca. 60 °C). Die theoretisch nach dem Faradayschen Gesetz erreichbare Schichtmasse beträgt für die gegebene Ladungsmenge 1426,6 mg/dm2. Die anodische Stromausbeute kann durch Division der gemessenen Schichtmasse durch die theoretisch erreichbare Schichtmasse berechnet werden. Die Abhängigkeit der Stromausbeute η von den Additivkonzentrationen zeigt Abbildung 3 (links). Für den Grundelektrolyt wurden im Mittel eine Schichtdicke von 42 µm und eine Flächenmasse von 855 mg/dm2 erhalten. Bei gleicher elektrischer Ladungsmenge nehmen Schichtdicke und Flächenmasse durch Zugabe von 0,4 mol/l sowie 0,8 mol/l HNO3 auf 44 µm und 964 mg/dm2 sowie 48 µm und 1025 mg/dm2 zu. Für 0,8 mol/l HNO3 ergibt sich also eine Steigerung der Schichtdicke um etwa 14 % und eine Erhöhung von Schichtmasse und Stromausbeute um etwa 20 %.

Abb. 3: Einfluss der Additivkonzentrationen auf die anodische Stromausbeute (links) und die spezifische elektrische Prozessenergie (rechts)
Es ist hervorzuheben, dass die Steigerung der Schichtmasse durch Zugabe von Salpetersäure nicht mit einer Erhöhung der elektrischen Energie verbunden ist. Wird die elektrische Energie auf die Schichtmasse bezogen, so ergibt sich für die Zugabe von 0,8 mol/l HNO3 gegenüber dem Grundelektrolyt eine Reduzierung der spezifischen elektrischen Prozessenergie ε um etwa 21 % (Abb. 3, rechts). Die Zugabe von Oxalsäure beeinflusst Schichtdicke und Schichtmasse nicht signifikant. Bei etwa gleichbleibender anodischer Stromausbeute (Abb. 3, links) ergibt sich aufgrund der erhöhten Prozessspannung eine Zunahme von ε um etwa 35 % (Abb. 3, rechts). Bei kombinierter Zugabe von 0,2 mol/l Oxalsäure und 0,8 mol/l Salpetersäure kompensieren sich die erhöhte Schichtflächenmasse und der erhöhte Energiebedarf gegenüber dem Grundelektrolyt (Abb. 3, rechts).
3 Porosität und Schichthärte
Die integrale Porosität p wurde unter der Annahme, dass die aus amorphem Aluminiumoxid bestehenden Konversionsschichten die gleiche Dichte aufweisen wie die kristallinen Phasen γ und α (ρ = 3.95 g/cm3), mithilfe der Schichtflächenmasse m und der Schichtdicke s nach Gleichung <1> berechnet:
p = 1-m/(s⋅ρ)<1>
Um die infolge der Porenaufweitung mit zunehmendem Abstand zum Substrat abnehmende Schichthärte möglichst präzise abzubilden, wurden an materialografisch präparierten Schichtquerschnitten mittels instrumentierter Nanoindentation unter Verwendung eines Berkovich-Indenters und einer Normalkraft von 5 mN Härteverläufe über die Schichtdicke aufgenommen. Die Diagonalen der Härteindrücke des Nanoindenters sind groß gegenüber der nanoskaligen Porosität (etwa 1 μm–2 μm Eindrucksdiagonale). Deshalb eignet sich die Nanoindentation zur Charakterisierung der nanoskaligen Porosität. Um Kenngrößen für die quantitative Beschreibung zu erhalten, erfolgte die Approximation der Härteverläufe durch die exponentielle Abhängigkeit der Härte H (in N/mm2) vom Substratabstand d (in μm) gemäß Gleichung <2>:
H = H0∙(H*)d<2>
Der Faktor H0 steht dabei für die theoretische Härte bei einem Substratabstand von 0 μm und wird für alle untersuchten Zustände als konstant angenommen (H0 = 4400 N/mm2). Der Wert H* beschreibt die Härteabnahme und wurde für alle Härteverläufe mithilfe der Methode der kleinsten Fehlerquadrate numerisch ermittelt. Für H* = 1 bleibt die Härte theoretisch über dem gesamten Schichtquerschnitt konstant. Für 0 < H* < 1 nimmt die Härte mit abnehmendem H* stärker über die Schichtdicke ab. Nach Approximation von H* wurde zudem die theoretische Härte H20 für einen Substratabstand von 20 μm als ein repräsentativer Härtekennwert mithilfe der Exponentialfunktion bestimmt.
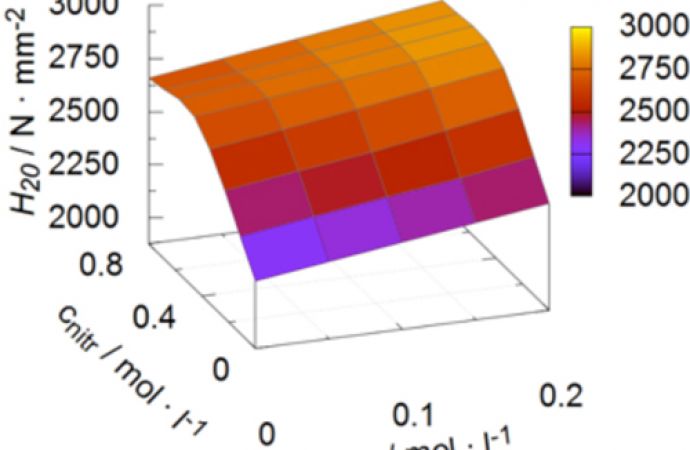
Intuitiv ist zu erwarten, dass die Schichthärte H20 mit sinkender Porosität p zunimmt. Dies bestätigt sich beim Vergleich von p und H20 in Abbildung 4 für die Erhöhung der Salpetersäurekonzentration. Im Gegensatz dazu nimmt die Schichthärte H20 mit steigender Oxalsäurekonzentration jedoch trotz steigender integraler Schichtporosität zu. Dieser scheinbare Widerspruch ist durch die getrennte Betrachtung von nanoskaliger Porosität (Porenkanäle und periodisch auftretende Hohlräume infolge der Sauerstoffentwicklung während der Oxidation der Kupferanreicherungen am Substrat-Schicht-Interface) und mikroskaliger Porosität (infolge der Umwandlung beziehungsweise Auflösung mikroskaliger Ausscheidungen verursachte Hohlräume und Fehlstellen) aufzulösen.

Abb. 4: Einfluss der Additivkonzentrationen auf die integrale Schichtporosität (links) und die Schichthärte H20 (rechts)
Die Steigerung der Oxalsäurekonzentration führt infolge der verringerten chemischen Rücklösung an den Porenwänden wie erwartet zu einer geringeren Härteabnahme über der Schichtdicke. Dies äußert sich in erhöhten Werten für H* und H20. Demgegenüber wird eine betragsmäßig größere Zunahme der Härte H20 durch Zugabe von Salpetersäure erreicht, insbesondere im Konzentrationsbereich zwischen 0 mol/l und 0,4 mol/l. Es ist bekannt, dass Kupfer im Vergleich zu Aluminium durch Salpetersäure stärker chemisch angegriffen und gelöst wird. Deshalb liegt die Vermutung nahe, dass Salpetersäure während des Anodisierens die Kupferanreicherungen am Substrat-Schicht-Interface chemisch auflöst. Auf diese Weise wird weniger Kupfer elektrochemisch unter Sauerstoffentwicklung in kupferreiches Oxid umgewandelt. Die reduzierte Gasentwicklung an der Anode erklärt die deutlich erhöhte Energieeffizienz sowie die erhöhte Schichthärte.
Mikroskalige Fehlstellen in den anodischen Oxidschichten mit etwa gleichem oder größerem Durchmesser im Vergleich zur Eindruckdiagonale können nicht mittels Nanoindentation erfasst werden. Deshalb erfolgte die Quantifizierung der mikroskaligen Porosität mittels Grauwertanalyse an REM-Aufnahmen des metallografisch präparierten Schichtquerschnitts. Wie aus Abbildung 5 hervorgeht, sind mikroskalige Poren deutlich anhand ihres niedrigen Grauwerts im Elementkontrast (Rückstreuelektronenbild) von kompakten, nanoporösen Schichtbereichen unterscheidbar. Die Vergrößerung wurde dabei bewusst so gering gewählt, dass ein großer, repräsentativer Schichtausschnitt erfasst wird und die nanoskalige Porosität nicht erkennbar ist. Im Grundelektrolyt hergestellte anodische Oxidschichten weisen, wie in der Einleitung beschrieben, sowohl abgerundete (Markierung 1 in Abb. 5) als auch größere, scharfkantigere Hohlräume (Markierung 2 in Abb. 5) auf. Diese sind auf die Umwandlung beziehungsweise Auflösung der ellipsoiden Al2CuMg-Ausscheidungen sowie der spratzigen, eisenreichen Ausscheidungen zurückzuführen.

Abb. 5: REM-Bilder (Elementkontrast) an metallografisch präparierten Schichtquerschnitten nach Anodisieren in 20 Vol.-% H2SO4 (oben), 20 Vol.-% H2SO4 + 0,8 mol/l HNO3 (Mitte) und 20 Vol.-% H2SO4 + 0,2 mol/l C2H2O4 (unten)
Durch Zugabe von 0,8 mol/l Salpetersäure nimmt die mikroskalige Porosität von etwa 3,4 % auf 4,6 % zu. Wie Abbildung 5 (Mitte) erkennen lässt, ist dies auf die Ausbildung von Rissen an scharfkantigen Hohlräumen zurückzuführen (Markierung 3). Noch deutlicher ausgeprägt sind diese Risse bei Zugabe von 0,2 mol/l Oxalsäure zum Grundelektrolyt (Abb. 5, unten). Daraus resultiert eine Zunahme der mikroskaligen Porosität auf 5,8 %. Das Substrat-Schicht-Interface weist sowohl für die Zugabe von Salpetersäure als auch für die Zugabe von Oxalsäure in der Nähe der angerissenen Hohlräume eine erhöhte Rauheit auf (Markierung 4 in Abb. 5). Dies deutet darauf hin, dass beide Additive die anodische Oxidation der eisenreichen Ausscheidungen inhibieren, sodass die Oxidation des Aluminiummischkristalls in der Umgebung bevorzugt wird. Da die Bildung von Aluminiumoxid mit einer Volumenzunahme verbunden ist, entstehen Zugeigenspannungen im Bereich der langsam umwandelnden eisenreichen Ausscheidung. Diese führen zur Rissbildung an scharfkantigen Stellen des bereits gebildeten Hohlraums. Die Beobachtung einer ausgeprägteren Rissbildung für die Zugabe von Oxalsäure legt nahe, dass Oxalsäure im Vergleich zu Salpetersäure eine größere inhibierende Wirkung besitzt.
4 Abriebbeständigkeit
Zur Beurteilung des Einflusses der nanoskaligen Porosität als auch der mikroskaligen Hohlräume und Risse auf die Abriebbeständigkeit der anodischen Oxidschichten wurden Ritzversuche mit einem Rockwell-Diamant-Indenter bei einer konstanten Normalkraft von 10 N und einer Relativgeschwindigkeit von 2,5 mm/min durchgeführt. Als Kenngröße diente dabei die Ritzenergiedichte WR. Diese gibt an, welche Furchungsarbeit nötig ist, um ein bestimmtes Materialvolumen an der Probenoberfläche durch Spanen abzutragen oder durch Pflügen zu verdrängen; sie wird nach Gleichung <3> berechnet:
WR = (Ft*l)/(A*l)<3>
Die Aufzeichnung der Tangentialkraft Ft erfolgte durch das Prüfgerät (Revetest-RST, CSM Instruments) über die Ritzlänge von 5 mm. Das Profil des Ritzquerschnitts wurde mittels Tastschnittgerät taktil erfasst. Der Ritzquerschnitt wurde durch Integration des Tiefenverlaufs über der Ritzbreite erhalten.
Der Widerstand anodischer Oxidschichten gegenüber Furchen steigt grundsätzlich mit abnehmender nanoskaliger Porosität. Andererseits führt insbesondere die Bildung von Mikrorissen an mikroskaligen Hohlräumen zu einer deutlichen Erhöhung des Furchungsverschleißes. Beide Effekte werden durch Zugabe von Salpetersäure und Oxalsäure zum Grundelektrolyt erzielt. Bei einer Konzentration von 0,4 mol/l HNO3 überwiegt noch der positive Einfluss der reduzierten nanoskaligen Porosität, sodass die Ritzenergiedichte gegenüber dem Grundelektrolyt um etwa 6 % auf 1,7 J/mm3 ansteigt. Demgegenüber ist für eine weitere Erhöhung der Salpetersäurekonzentration sowie für die Zugabe von Oxalsäure eine Abnahme der Ritzenergiedichte infolge erhöhter Mikrorissigkeit feststellbar.
Das Schädigungsverhalten der anodischen Oxidschichten wurde mittels progressiver Ritzversuche bewertet. Dabei erfolgte eine lineare Steigerung der Normalkraft von 1 N bis 100 N über eine Prüflänge von 10 mm. Als Schichtversagen ist die Freilegung des metallischen Substrats definiert. Für den Grundelektrolyt sowie die Zugabe von 0,4 mol/l HNO3 wurde großflächiges Abplatzen für relativ hohe Normalkräfte von etwa 49 N beziehungsweise 45 N beobachtet (Abb. 6, oben). Dieses Versagen ist typisch für harte, spröde Schichten und wird durch Druckeigenspannungen vor der Indenterspitze verursacht.

Abb. 6: Lichtmikroskopische Aufnahmen des Schichtversagens im progressiven Scratch-Test nach Anodisieren in 20 Vol.-% H2SO4 (oben), 20 Vol.-% H2SO4 + 0,2 mol/l C2H2O4 (Mitte) und 20 Vol.-% H2SO4 + 0,8 mol/l HNO3 (unten)
Nach Anodisieren mit einer Oxalsäurekonzentration von 0,2 mol/l und einer Salpetersäurekonzentration von 0 mol/l oder 0,4 mol/l ist ein Übergang hin zum gleichmäßigen Abrieb der Oxidschicht feststellbar (Abb. 6,Mitte). Die Freilegung des Substrats erfolgte bei geringeren Normalkräften von 33 N beziehungsweise 42 N. Für eine hohe Salpetersäurekonzentration von 0,8 mol/l wurde bereits bei sehr geringen Normalkräften die Freilegung des Substrats beobachtet. Es liegt die Schlussfolgerung nahe, dass die nach dem Anodisieren vorliegenden Risse bereits bei geringer Normalkraft zu einem Rissnetzwerk wachsen. Infolge dessen werden größere Schichtbereiche separiert und abgetragen.
5 Zusammenfassung
Sowohl Oxalsäure als auch Salpetersäure eignen sich als Additive zur Steigerung der Schichthärte beim Hartanodisieren der Legierung AlCu4Mg1 in schwefelsaurer Lösung. Die Wirkungsmechanismen der Additive sind jedoch vollkommen unterschiedlich. Durch Adsorption von Oxalationen wird die chemische Rücklösung an den Porenwänden reduziert und es resultiert eine geringere Härteabnahme über die Schichtdicke. Aufgrund der deutlich erhöhten Prozessspannung infolge der Zugabe von Oxalsäure steigt jedoch die spezifische elektrische Energie für den Anodisierprozess um 34 %. Demgegenüber ermöglicht die Zugabe von Salpetersäure eine deutlichere Erhöhung der Schichthärte bei gleichzeitiger Reduzierung der spezifischen elektrischen Prozessenergie um 21 %. Dies ist erklärbar durch die verstärkte chemische Auflösung der Kupferanreicherung am Substrat-Schicht-Interface in Elektrolyten mit Salpetersäure. Der negative Einfluss des Legierungselements Kupfer auf Stromausbeute und Schichtkompaktheit wird somit verringert.
Die Verwendung beider Additive führt zur verstärkten Ausbildung von Mikrorissen in den Oxidschichten. Aufgrund der erhöhten Rauheit des Substrat-Schicht-Interfaces in der Nähe von Fehlstellen, die auf die Umwandlung beziehungsweise Auflösung eisenreicher Ausscheidungen zurückzuführen sind, liegt die Vermutung nahe, dass beide Additive die Umwandlung dieser Phasen inhibieren. Mit zunehmender Mikrorissigkeit sinkt die Abriebbeständigkeit der Oxidschichten und der Versagensmechanismus geht vom Abplatzen bei hohen Normalkräften zum gleichmäßigen Abtrag der Schichten bei geringen Normalkräften über.
Die gleichzeitige Erhöhung von Schichthärte und Energieeffizienz ist für das Hartanodisieren der Legierung AlCu4Mg1 bei einer Salpetersäurekonzentration von 0,4 mol/l ohne Beeinträchtigung der Abriebbeständigkeit realisierbar. Die Eignung der Salpetersäurezugabe für die Verbesserung der Anodisierbarkeit von Aluminium-Kupfer-Legierungen bei Raumtemperatur, beispielsweise hinsichtlich ihrer Färbbarkeit, ist Gegenstand weiterer Untersuchungen.
Danksagung
Die Autoren bedanken sich bei der Deutschen Forschungsgemeinschaft (DFG) für die Förderung der vorgestellten Arbeiten im Rahmen des Sonderforschungsbereichs 692 HALS sowie bei Dagmar Dietrich, Dagobert Spieler, Elke Benedix, Christel Pönitz, Paul Clauß und Frank Simchen für die technische Unterstützung.
Literatur
[1] G. E. Thompson, H. Habazaki, K. Shimizu, M. Sakairi, P. Skeldon, X. Zhou, G. C. Wood: Anodizing of aluminium alloys; Aircr. Eng. Aerosp. Technol. 1999, 71, 228–238
[2] M. Curioni, F. Roeth, S. J. Garcia-Vergara, T. Hashimoto, P. Skeldon, G. E. Thompson, J. Ferguson: Enrichment, incorporation and oxidation of copper during anodizing of aluminium-copper alloys; Surf. Interface Anal. 2010, 42, 234–240
[3] T. Hashimoto, X. Zhou, P. Skeldon, G. E. Thompson: Structure of the Copper–Enriched Layer Introduced by Anodic Oxidation of Copper-Containing Aluminium Alloy; Electrochim. Acta 2015, 179, 394–401
[4] Y. Ma, X. Zhou, G. E. Thompson, M. Curioni, X. Zhong, E. Koroleva, P. Skeldon, P. Thomson, M. Fowles: Discontinuities in the porous anodic film formed on AA2099-T8 aluminium alloy; Corros. Sci. 2011, 53, 4141–4151
[5] R. Giovanardi, C. Fontanesi, W. Dallabarba: Adsorption of organic compounds at the aluminium oxide/aqueous solution interface during the aluminium anodizing process; Electrochim. Acta 2011, 56, 3128–3138
[6] M. Sieber, R. Morgenstern, T. Lampke: Anodic oxidation of the AlCu4Mg1 aluminium alloy with dynamic current control; Surf. Coat. Technol. 2016, 302, 515–522
[7] M. Sieber, R. Morgenstern, I. Scharf, T. Lampke: Effect of Nitric and Oxalic Acid Addition on Hard Anodizing of AlCu4Mg1 in Sulphuric Acid; Metals-Basel 2018, 8, 139
DOI: 10.7395/2018/Scharf8