Refraktärmetalle besitzen neben ihrer extremen thermischen Beständigkeit (Schmelzpunkt > 1850 °C) hervorragende mechanische Eigenschaften und weisen außerdem eine hohe chemische Beständigkeit gegenüber aggressiven Medien auf. Zu dieser Materialklasse gehören unter anderem Tantal, Titan und Niob. In der Mikroelektronik finden Tantal und Niob beispielsweise Anwendung als Diffusionsbarrieren, um die Migration von Kupfer in das Siliziumsubstrat zu verhindern. In der Medizintechnik werden vor allem Titan und Tantal aufgrund ihrer guten Biokompatibilität als Materialien für Implantate eingesetzt. In der chemischen Industrie werden Refraktärmetalle wiederum zumeist für den Korrosionsschutz verwendet. Durch die Abscheidung von Refraktärmetalllegierungen können die Eigenschaften der Beschichtung dem Anwendungsziel individuell angepasst werden. Um Materialkosten einzusparen, wird bei der Anwendung oft mit Beschichtungen gearbeitet. Im Gegensatz zu anderen üblichen Beschichtungsmethoden für Refraktärmetalle, wie beispielsweise chemische Gasphasenabscheidung (englisch: chemical vapour deposition, CVD) und physikalische Gasphasenabscheidung (englisch: physical vapour deposition, PVD) bietet die elektrochemische Abscheidung eine kostengünstige und gut zu handhabende Methode, um auch komplexe Geometrien zu beschichten. Aufgrund des negativen Standardpotentials von Refraktärmetallen können diese aus wässrigen Medien nicht abgeschieden werden. Als alternative Medien bieten ionische Flüssigkeiten (IFs) viele Vorteile. Ionische Flüssigkeiten liegen wegen ihrer chemischen Struktur (zumeist Moleküle mit langen Alkylseitenketten und asymmetrischer Ladungsverteilung) bereits bei Temperaturen unter 100 °C (z. T. schon bei Raumtemperatur) in flüssiger Phase vor, besitzen einen niedrigen Dampfdruck und haben ein elektrochemisches Stabilitätsfenster von 5 V bis 6 V.
Electrodeposition of refractory metal alloys by ionic liquids
Refractory metals have an excellent thermal stability (melting point > 1850 °C), extraordinary mechanical properties and a high chemical stability against aggressive media. Tantalum, titanium and niobium belong to this class of materials. Tantalum and niobium are used as diffusion barriers in microelectronics to prevent the diffusion of copper atoms into the silicon wafer. Titanium and tantalum are used as materials for implants. Refractory metals are employed mostly for protection against corrosion in chemical industry. Coatings are a cost-effective way to protect materials from aggressive media. In contrast to other coating processes for refractory metals like chemical vapor deposition (CVD) and physical vapor deposition (PVD), electrochemical deposition is an inexpensive method which can be used for complex geometries. Through the electrodeposition of refractory metal alloys, the properties of coatings can be individually designed. Because of their negative standard potentials, refractory metals cannot be electrodeposited from aqueous media. As an alternative media ionic liquids (IFs) provide many advantages. Due to their chemical structure (mostly molecules with long alkyl-chains and asymmetric charge distribution), IFs are liquid at temperatures below 100 °C (some ILs have a melting point below room temperature), have a low vapor pressure and a large electrochemical stability window of 5 V to 6 V.
1 Motivation
Refraktärmetalle (lat.: refractarius = widerspenstig, halsstarrig) sind Übergangsmetalle der vierten (Titan, Zirconium und Hafnium), fünften (Vanadium, Niob und Tantal) und sechsten (Chrom, Molybdän und Wolfram) Nebengruppe. Durch die Neigung, an Luft eine passivierende Oxidschicht zu bilden, finden Refraktärmetalle oft Anwendung unter extremen Bedingungen. Die hervorragende Verschleißbeständigkeit besteht auch bei hohen bis sehr hohen Temperaturen. Zudem besitzen sie eine hohe Korrosionsfestigkeit und eine gute Wärmeleitfähigkeit bei gleichzeitig guter Duktilität [1].
Besonders der Schutz vor Korrosion ist in vielen Industriezweigen von enormer wirtschaftlicher Bedeutung und bietet für die sehr korrosionsbeständigen Refraktärmetalle wie zum Beispiel Tantal ein breites Anwendungsfeld. Die Korrosion von Bauteilen kann zur Beeinträchtigung ihrer Funktion oder gar zum Ausfall ganzer Maschinen und damit zur Unterbrechung der Produktionskette führen. Neben diesen sogenannten Primärkosten durch die Reparatur oder den Austausch von Bauteilen, welche von Korrosion befallen sind, können die Sekundärkosten oft weitaus höher ausfallen (z. B. die Beseitigung des ölverseuchten Bodens bei Korrosionsleckagen von erdverlegten Öltanks). So entstehen weltweit jährlich Kosten von etwa 2,5 Billionen Dollar (Studie von NACE International 2016) für die Reparatur von durch Korrosion entstandenen Schäden. Das entspricht etwa 3,4 Prozent des Welt-Brutto-Inlandproduktes [2]. Das Marktpotential für Refraktärmetallbeschichtungen ist daher vor allem im Bereich des Korrosionsschutzes enorm. Dabei weisen Tantal und Wolfram vor allem in sauren Medien die beste Korrosionsbeständigkeit auf. Durch das Hinzulegieren von Titan kann die Korrosionsbeständigkeit in basischen Medien nochmals verbessert werden [3, 4]. Auch in der Medizintechnik haben Refraktärmetalle vielfältige Anwendungen. Durch den Einsatz von Tantal- oder Titan-beschichteten Implantaten kann deren Lebensdauer bei uneingeschränkter Funktion um ein Vielfaches erhöht werden(Abb. 1).

Abb. 1: Vergleich herkömmlicher Bandscheibenimplantate und mit Tantal beschichteter Implantate nach mehreren Jahrzehnten Nutzung [17]

Abb. 2: Verschiedene Implantate aus Tantal-Titan-Legierungen[18]
Zusätzlich zu ihrer hohen Beständigkeit gegenüber Korrosion weisen Titan und Tantal eine sehr gute Biokompatibilität auf und werden daher als Materialien für Implantate (Abb. 2) eingesetzt. Tantal wird in der Medizin unter anderem als Material für Stents zur Verhinderung einer arteriellen Hypotonie (Kollaps durch zu niedrigen Blutdruck) oder für Gefäßklemmen (mit dem besonderen Vor-teil, dass sich Tantal nicht ferromagnetisch verhält und somit für MRT-Scans geeignet ist) genutzt. Tantal-Titan-Legierungen besitzen sowohl eine hohe Beständigkeit gegenüber Korrosion unter basischen als auch unter sauren Bedingungen. Zudem erhöht sich die Abriebfestigkeit bei gleichzeitiger verbesserter Elastizität im Vergleich zu reinem Titan. Somit kann eine Elastizität erreicht werden, welche im Bereich eines Knochens liegt [3, 4].
Niob-Titan-Legierungen werden als Magnetmaterialien für wichtige bildgebende Verfahren, wie zum Beispiel Computertomographen (CT) oder Magnetresonanztomographen (MRT) in der Medizin eingesetzt (Abb. 3, links). Die Legierung wird dabei in flüssigem Helium auf Temperaturen nahe dem absoluten Nullpunkt (ca. 5 K) gekühlt. Dies führt dazu, dass die Legierung supraleitende Eigenschaften erhält. Supraleiter bilden sehr starke elektromagnetische Felder, was essenziell für diese bildgebenden Verfahren ist [5, 6]. Durch das Legieren von Tantal mit Niob (Niobanteil bis zu 2,4 wt.-%) ändert sich das supraleitende Verhalten des Metalls signifikant. Reines Tantal verhält sich wie ein schwach gekoppelter Supraleiter, während Tantal-Niob-Legierungen das Verhalten eines Supraleiters vom Typ II zeigen [7]. Zudem werden Tantal-Niob-Legierungen aufgrund ihrer hohen Härte bei gleichzeitig guter Elastizität als Material für die Schaufeln in Gasturbinen eingesetzt (Abb. 3, rechts).

Abb. 3: MRT-Gerät mit Niob-Titan-Magneten (links [19]) und Gasturbine eines Flugzeugs mit Schaufeln aus Tantal-Niob-Legierung (rechts [20])
2 Ionische Flüssigkeiten
Ionische Flüssigkeiten sind Salze, deren Schmelzpunkt unterhalb von 100 °C (zum Teil unterhalb von Raumtemperatur) liegt und vollständig aus Ionen bestehen. Der niedrige Schmelzpunkt ist durch die Ladungsdelokalisierung und durch sterische Effekte (Moleküle mit langen Alkylketten) bedingt.
Die erste ionische Flüssigkeit Ethylammoniumnitrat ([EtNH3][NO3]) mit einem Schmelzpunkt von 12 °C wurde 1914 von Paul Walden entdeckt. Er untersuchte dabei den Zusammenhang zwischen der Molekülstruktur und dem Schmelzpunkt. Ethylammoniumnitrat gehört zur Klasse der protischen ionischen Flüssigkeiten, welche seit Anfang der 2000er Jahre durch die Arbeiten von Hiroyuki Ohno eine wichtige Unterkategorie der Ionischen Flüssigkeiten darstellt [8]. Trotz dieser interessanten Entdeckung von Paul Walden, blieben Ionische Flüssigkeiten lange Zeit unbeachtet. Erst etwa 40 Jahre später untersuchten die Wissenschaftler Hurley und Weir den schmelzpunktsenkenden Effekt durch das Mischen von 1-alkylpyridinium Halogeniden mit anorganischen Salzen wie BrAlCl3. Die Phasendiagramme dieser Mischungen enthielten zwei Eutektika, bei einem Mischverhältnis 1:2 (45 °C) und bei 2:1 (40 °C).
In den frühen 1980ern Jahren stellte John Wilkes die erste IF mit dem Kation 1,3-dialkylimidazolium vor. Die Ionischen Flüssigkeiten der Klasse 1-alkyl-3-methylimidazoliumchlorid Aluminiumchlorid ([CnC1im]Cl-AlCl3, mit n = 1–4), werden heute für die elektrochemische Abscheidung von Aluminium und Aluminiumlegierungen eingesetzt. Dabei besitzt das System [C2C1im]Cl-AlCl3 die besten Transporteigenschaften [9].
Ein weiterer wichtiger Beitrag von Wilkes war die Einführung wasser- und luftstabiler Ionischer Flüssigkeiten (1992), welche durch ihre hydrophoben Eigenschaften weniger reaktiv mit Wasser und Sauerstoff sind. Dieser Anstoß führte später zu einer Reihe von weiteren aprotischen Ionischen Flüssigkeiten auf Basis von beispielsweise Phosphonium, Pyrrolidinium, Ammonium, Sulfonium und Pyridinium (Abb. 4).

Abb. 4: Übersicht wichtiger IF-Kationen (oben) und IF-Anionen (unten) für die elektrochemische Abscheidung [10]
Der niedrige Schmelzpunkt zählt, neben der Lebensdauer der Anlagen, zu den wichtigsten Aspekten der Wirtschaftlichkeit von Beschichtungsmethoden. IFs besitzen noch einige weitere besondere Eigenschaften, die sie auch für die Anwendung als Lösungsmittel bei der elektrochemischen Abscheidung von Metallen sehr attraktiv machen.
Neben dem niedrigen Dampfdruck und der schweren Entflammbarkeit ist für die Elektrochemie vor allem das große elektrochemische Stabilitätsfenster ein bedeutender Vorteil (bis zu 6 V). Dadurch ist es möglich, eine Reihe technologisch wichtiger Metalle wie Tantal, Niob, Titan, Aluminium oder Wolfram elektrochemisch abzuscheiden. Im Vergleich zu anderen nichtwässrigen Medien heben sich Ionische Flüssigkeiten vor allem durch ihre relativ hohe Leitfähigkeit hervor.
Neben den vielen Vorteilen, welche die Anwendung von Ionischen Flüssigkeiten für die elektrochemische Abscheidung von Metallen mit sich bringt, gibt es aber auch einige Herausforderungen, welche in Zukunft adressiert werden müssen, um diese breitflächig für die industrielle Anwendung zu etablieren.
Bisher gibt es zum Beispiel nur eine geringe Anzahl an Langzeitstudien zur Auswirkung von Ionischen Flüssigkeiten auf die Umwelt. Erste Untersuchungen zeigen, dass Ionische Flüssigkeiten mit dem Kation Pyrrolidinium anstelle von Pyridinium eine geringere Toxizität aufweisen. Ebenso wirken sich längere Alkylketten steigernd auf die Umweltverträglichkeit von Ionischen Flüssigkeiten aus [10, 11]. Die Zusammensetzung [EMIM][OAc] (1-Ethyl-3-Methyl Imidazolium Acetat) wurde 2018 erfolgreich bei REACh (Registrierung, Evaluierung und Autorisierung von Chemikalien) registriert [12]. Dennoch gibt es hinsichtlich des Einflusses von Ionischen Flüssigkeiten auf die Umwelt noch weiteren Forschungsbedarf. Derzeit ist die Mehrheit der Stoffe noch mit dem Vermerk Vorsicht, Produkt noch nicht vollständig untersucht versehen. Zudem müssen einige Aspekte der Hochskalierung, welche hauptsächlich die Langzeitstabilität der Anlagen betreffen, noch näher untersucht werden.
Es gilt aber auch, bei der Abscheidung aus Ionischen Flüssigkeiten die unterschiedlichen physikochemischen Eigenschaften im Vergleich zu wässrigen Medien zu beachten. Hierbei beeinflusst vor allem die Struktur des Kations die Viskosität der Ionischen Flüssigkeit und damit den Massentransport der elektrochemisch aktiven Spezies zur Arbeitselektrode. Zudem wird die elektrochemische Doppelschicht an der Kathode vom Kation der Ionischen Flüssigkeit dominiert, was sich letztendlich auf die Schichtmorphologie auswirkt. Die elektrochemische Doppelschicht von Ionischen Flüssigkeiten kann außerdem nicht mit der Theorie von wässrigen Medien erklärt werden. Sie ist wesentlich komplexer aufgebaut (hohe Anzahl alternierender Kation-Anion-Schichten) und wird stark beeinflusst vom anliegenden Potential an der Elektrode (durch die Beweglichkeit der Alkylketten) oder von gelösten Salzen im Elektrolyten [13].
3 Experimentelle Ergebnisse
Für die Untersuchungen zur Abscheidung von Tantallegierungen wurde ein Drei-Elektrodenaufbau verwendet (Abb. 5, links). Dabei wurde als Arbeitselektrode ein Kupferblech, als Gegenelektrode ein Platindraht und als Referenzelektrode (RE) eine speziell für die Abscheidung aus Ionischen Flüssigkeiten hergestellte Ferrocen/Ferrocenium RE verwendet. Bei der RE handelt es sich um eine Glaskapillare, welche mit einer 5 Mm Ferrocen-IF-Lösung gefüllt ist. Die Ionische Flüssigkeit der Referenzelektrode ist die selbe wie im untersuchten System. In der Lösung befindet sich ein Platindraht. Zur Vermeidung der Kontamination des Elektrolyten, ist die Kapillare mit einer porösen Glasfritte (Vycorglas mit einem durchschnittlichen Porendurchmesser von 10 nm) abgetrennt. Im Gegensatz zu den häufig verwendeten Platin-Quasireferenzelektroden kann mit dieser Referenzelektrode das üblicherweise auftretende Driften des Potentials vermieden werden. Diese Elektrode kann über mehrere Wochen stabil und reproduzierbar das Potential messen (Abb. 5, rechts).

Abb. 5: Drei-Elektrodenanordnung für die Abscheidung von Refraktärmetalllegierungen (links); Ferrocen/Ferrocenium Referenzelektrode (rechts)
3.1 Tantal-Niob-Legierungen
Für die Abscheidung von Refraktärmetallen werden zumeist Halogenidpräkursoren (z. B. TaF5, TaCl5, NbF5 oder NbCl5) als Ausgangsmaterialien verwendet [14, 15]. Die Auswahlmöglichkeit kommerziell erhältlicher Präkursoren für Tantal und Niob ist derzeit recht übersichtlich. Sowohl Tantal als auch Niob liegen überwiegend in der Oxidationsstufe +5 vor. Daher ist bei der elektrochemischen Abscheidung von Refraktärmetallen von einem mehrstufigen Reduktionsmechanismus auszugehen, was das Auftreten von Komproportionierungs- (z. B. Ta (II) + Ta (II) à 2 Ta (IV)) oder Disproportionierungsreaktionen (z. B. 2 Ta (III) à Ta (I) + Ta (II)) oder die Co-Abscheidung von Zwischenprodukten begünstigt [16].
Für die Abscheidung von Tantal-Niob-Legierungen aus Ionischen Flüssigkeiten wurden unterschiedliche Tantal- und Niobhalogenide miteinander kombiniert und in den beiden Systemen [BMP][TFSI] (1-Butyl-1-Methylpyrrolidinium Bis(trifluoromethylsulfonyl)imide) und [BMP][OTf] (1-Butyl-1-Methylpyrrolidinium trifluoromethansulfonat) gelöst. Für die Abscheidungsversuche wurde eine Temperatur von 100 °C ausgewählt, die Konzentration des Tantalpräkursors betrug 0,25 M und die Konzentration des Legierungspartnersalzes 0,1 M beziehungsweise 0,25 M.
Zur Untersuchung des elektrochemischen Verhaltens dieser Systeme wurde zunächst ein Cyclovoltammogramm (CV) (Abb. 6) aufgenommen, um die Potentiale der Reduktionsprozesse zu identifizieren. Zunächst zeigt sich, dass durch die Zugabe von 0,25 M Niobfluorid (NbF5) im äquimolaren Verhältnis die Ströme im Vergleich zum Cyclovoltammogramm von TaF5 [BMP][OTf] ohne Legierungspartner sich stark verringern. Durch die Erniedrigung der Konzentration von Niobfluorid auf 0,1 M kann dieser Effekt deutlich verringert werden. Das Cyclovoltammogramm zeigt das Auftreten von mehreren elektrochemischen Reduktionsreaktionen, jedoch konnte bei potentiostatischer Abscheidung (konstant gehaltenes Abscheidungspotential) keine Abscheidung an den Peakpotentialen beobachtet werden. Aus dem System TaF5 NbF5 [BMP][OTf] konnte keine Schicht erhalten werden. Dies kann mit der schlechten Abscheidbarkeit von Niob aus NbF5 [BMP][OTf] erklärt werden. Hierbei bilden sich lediglich sehr dünne Schichten von Niob.

Abb. 6: Cyclovoltammogramm verschiedener Tantal- und Niobpräkursoren in [BMP][OTf] bei 100 ° C auf Kupfer mit einer Vorschubgeschwindigkeit von 10 mV/s

Abb. 7: Schichtanalyse nach 30-minütiger potentiostatischer Abscheidung aus 0,25 M TaF5 und 0,1 M NbCl5 in [BMP][OTf] an Kupfer bei 100 °C; A) REM-Aufnahme, B) Beschichtung direkt nach Abscheidung (oben) und nach circa 24 h (unten), C) Schichtzusammensetzung (EDX)
Bei der Änderung des Niobpräkursors zu Niobchlorid (NbCl5) ergeben sich ähnlich hohe Ströme. Bei einer potentiostatischen Abscheidung bei -2,0 V vs. Fc/Fc+ konnten dicke und kompakte Schichten erzeugt werden (Abb. 7). Diese Schichten zeigten jedoch bei der Analyse mit der energiedispersiven Röntgenspektroskopie (EDX) keinen Niobgehalt und lediglich einen Tantalgehalt von 22 ± 5 wt.-%. Auffällig ist der hohe Gehalt an Chlorid (24 ± 5 wt.-%). Üblicherweise tritt bei der Abscheidung von Refraktärmetallen eine Co-Abscheidung von Zwischenspezies (z. B. NbCl2) auf, wodurch die Niobschichten einige Gewichtsprozent Chlor enthalten können. Da bei der Abscheidung aus dem System TaF5 NbCl5 [BMP][OTf] jedoch kein Niob enthalten ist, deutet der hohe Chloridgehalt auf das Auftreten einer Reaktion des Elektrolyten mit dem Kupfersubstrat hin. Zudem verfärben sich die Schichten bei Kontakt mit Luft nach einigen Stunden von der ursprünglichen schwarz-gräulichen Farbe zu einem bläulichen Grün. Diese Erscheinung deutet auf die Bildung von Kupferchlorid (CuCl2) durch die Reaktion von freiwerdenden Chloridionen bei der Reduktion von Niobchlorid (NbCl5) hin.
Insgesamt wurden für die Abscheidung von Tantal-Niob-Legierungen aus Ionischen Flüssigkeiten sechs Systeme (Tab. 1) untersucht. Dabei konnte bisher aus keinem der Systeme eine Schicht mit Tantal und Niob abgeschieden werden. Anders als aus wässrigen Medien bekannt, scheint bei der Abscheidung von Tantal-Niob die Legierungsabscheidung nicht energetisch begünstigt zu sein (induzierte Co-Abscheidung).

3.2 Tantal-Titan-Legierungen
Für die Abscheidung von Tantal-Titan-Legierungen aus Ionischen Flüssigkeiten wurde wie bei Tantal-Niob-Legierungen ein Screening verschiedener Systeme aus Halogenid und Ionischer Flüssigkeit durchgeführt. Die Abscheidungstemperatur betrug wiederum 100 °C, die Konzentration des Tantalpräkursors 0,25 M und die Konzentration des Tantalsalzes 0,1 M beziehungsweise 0,25 M.
Bei der Untersuchung des elektrochemischen Verhaltens mittels Cyclovoltammogrammes (Abb. 8) zeigt sich ein ähnliches Bild wie bei den Tantal-Niob-Systemen. Durch die Zugabe von Titanfluorid (TiF4) im äquimolaren Verhältnis sind im CV nur noch minimale Ströme zu detektieren. Ähnlich wie beim System TaF5 NbF5 [BMP][OTf] kann durch das Senken der Konzentration von Titanfluorid auf 0,1 M dieser Effekt vermindert werden, jedoch ist der positive Effekt der niedrigeren Konzentration beim System TaF5 TiF4 [BMP][OTf] weniger ausgeprägt als bei TaF5 NbF5 [BMP][OTf].

Abb. 8: Cyclovoltammogramme verschiedener Tantal- und Titanpräkursoren in [BMP][OTf] bei 100 °C an Kupfer mit einer Vorschubgeschwindigkeit von 10 mV/s

Abb. 9: Schichtanalyse nach 30-minütiger potentiostatischer Abscheidung aus 0,25 M TaF5 und 0,1 M TiCl4 in [BMP][OTf] an Kupfer bei 100 °C; A)REM-Aufnahme, B) Beschichtung direkt nach der Abscheidung, C) Schichtzusammensetzung (EDX)
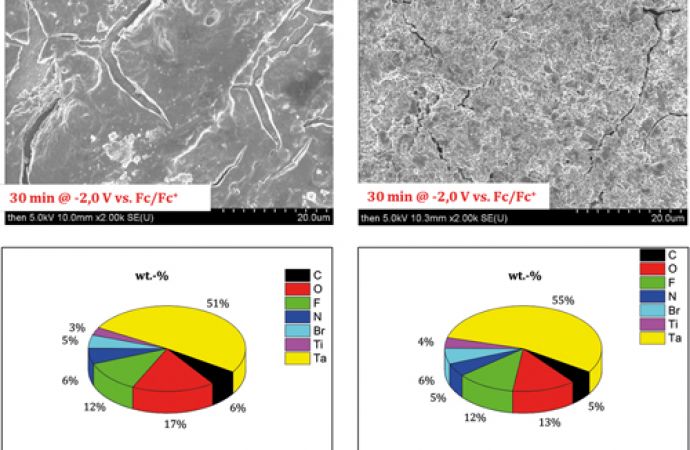
Beim Einsatz von Titanchloric (TiCl4) als Titanpräkursor können im Cyclovoltammogramm des Systems TaF5 TiCl4 [BMP][OTf] mehrere Reduktionsreaktionen detektiert werden bei vergleichsweise hohen Stromdichten. Eine 30-minütige potentiostatische Abscheidung bei -2,0 V vs. Fc/FC+ ergab eine dünne Schicht (Abb. 9). Bei der Analyse der Schicht mittesls EDX (Beschleunigungsspannung 24 kV) ergab sich ein Tantalgehalt von 68 ± 8 wt.-%, jedoch enthielt die Schicht kein Titan. Deshalb wurde das System TaF5 TiBr4 [BMP][TFSI] untersucht, wobei aus dieser Ionischen Flüssigkeit mit den ausgewählten Präkursoren in Reinmetallabscheidungsversuchen sowohl tantalhaltige als auch titanhaltige Schichten abgeschieden werden konnten. Auch bei diesem System konnten keine Tantal-Titan-Schichten abgeschieden werden. Demnach scheint die Abscheidbarkeit der Reinmetalle kein hinreichender Faktor für eine erfolgreiche Abscheidung von Tantal-Titan-Legierungen zu sein.
Als weitere Präkursorkombination wurde Tantalbromid (TaBr5) und Titanbromid (TiBr4) in den Ionische Flüssigkeiten [BMP][TFSI] und [BMP][OTf] untersucht (Abb. 10).

Abb. 10: Cyclovoltammogramme von 0,25 M TaBr5 und 0,1 M TiBr4 in [BMP][TFSI] und [BMP][OTf] bei 100 °C an Kupfer mit einer Vorschubgeschwindigkeit von 10 mV/s

Abb. 11: Schichtanalyse nach 30-minütiger potentiostatischer Abscheidung aus 0,25 M TaF5 und 0,1 M TiBrl4 in zwei IFs an Kupfer bei 100 °C; A) REM-Aufnahme der Schicht aus [BMP][TFSI], B) Schichtzusammensetzung aus [BMP][TFSI] (EDX), C) REM-Aufnahme der Schicht aus [BMP][OTf], B) Schichtzusammensetzung aus [BMP][OTf] (EDX)
Die Cyclovoltammogramme zeigen mehrere elektrochemische Reduktionsreaktionen, wobei das sehr ähnliche elektrochemische Verhalten auffällt. Bei 30-minütiger potentiostatischer Abscheidung bei -2,0 V konnten aus beiden Systemen Schichten erhalten werden (Abb. 11). Diese zeigten einen Tantalgehalt von etwa 55 ± 3 wt.-% und einen Titangehalt von 3,0 ± 0,3 wt.-%; aus [BMP][OTf] mit einem Tantalgehalt von etwa 55 ± 3 wt.-% und einem Titangehalt von 4,0 ± 0,4 wt.-% aus [BMP][TFSI]. Der Refraktärmetallgehalt ist aus beiden Ionischen Flüssigkeiten ähnlich. Die Schichtmorphologie wird jedoch von der Ionischen Flüssigkeit stark beeinflusst. Die Schicht aus [BMP][OTf] ist weitaus weniger rissig und weist eine grobkörnigere Struktur auf. Die Schicht aus [BMP][TFSI] hingegen ist ebener, jedoch weist sie vermehrt Risse auf, welche auf die Entstehung von Spannungen in der Schicht bei der Abscheidung zurückzuführen sind. Weitere potentiostatische Abscheidungsversuche ergaben sowohl bei negativeren als auch positiveren Potentialen einen sinkenden Trend für den Titangehalt bei einem ähnlichen Tantalgehalt.
Für die Abscheidung von Tantal-Titan-Legierungen wurden insgesamt elf Systeme (Tab. 2) untersucht, wobei eine erfolgreiche Abscheidung von Schichten mit Tantal und Titan mit der Präkursorkombination von TaBr5 TiBr4 in [BMP][TFSI] und [BMP][OTf] gelang.
4 Fazit
Die Beschichtung von Materialien mit Tantallegierungen ist eine aussichtreiche Methode, um ressourcen- und kosteneffizient Trägermaterialien vor Korrosion und Verschleiß zu schützen. Die Wirtschaftlichkeit einer elektrochemischen Beschichtung im Vergleich zu anderen üblichen Methoden wie PVD oder CVD machen diese Prozessform zu einer attraktiven Alternative. Da Refraktärmetalle aufgrund ihres negativen Standardpotentials nicht aus wässrigen Medien abgeschieden werden können, muss für die elektrochemische Beschichtung mit Tantallegierungen auf andere Medien wie Ionische Flüssigkeiten ausgewichen werden. Neben den Vorteilen, wie die niedrige Prozesstemperatur und dem breiten elektrochemischen Stabilitätsfenster, bringt die Verwendung von Ionischen Flüssigkeiten auch einige Herausforderungen mit sich, für deren Lösung in den nächsten Jahren noch Forschungsbedarf besteht.
Wie gezeigt werden kann, ist es bereits möglich, Schichten aus Tantal mit Titan aus Ionischen Flüssigkeiten abzuscheiden. Für die erfolgreiche Herstellung galvanisch abgeschiedener Legierungen ist die Abscheidbarkeit der Reinmetalle aus der verwendeten Ionischen Flüssigkeit eine wichtige Voraussetzung.
Weiterhin zeigten die Untersuchungen, dass die Gleichartigkeit des Präkursoranions eine wichtige Bedingung für eine erfolgreiche Abscheidung ist. Zudem ist das Lösungsverhalten der Präkursoren in der Ionischen Flüssigkeit ein wichtiger Aspekt. Dabei sollte ein Anionenaustausch zwischen Ionischer Flüssigkeit und dem Präkursor stattfinden. Die teilweise bei der Herstellung der Elektrolyte beobachtete geringe Löslichkeit einiger Präkursoren (vor allem TaCl5, TiF4 und NbF5) deutet auf eine geringe Wechselwirkung der Salze mit [BMP][TFSI] und [BMP][OTf] hin. Während des Abscheidungsprozesses scheinen elektrochemische und/oder chemische Nebenreaktionen stattzufinden, die dafür sorgen, dass die erhaltenen Schichten einen erhöhten Fremdelementgehalt besitzen, welcher sich negativ auf die Haftfestigkeit und die Morphologie auswirkt.
Die hohe Oxidationsstufe der kommerziell erhältlichen Refraktärmetallpräkursoren kompliziert den Reduktionsmechanismus und erfordert sehr negative Potentiale zur Abscheidung von Refraktärmetallen. Dies kann dazu führen, dass adsorbierte Ionische Flüssigkeit an der Kathode Ionen an der Abscheidung behindern. Um die Nebenreaktionen und die Co-Abscheidung von Zwischenprodukten zu unterbinden, wird der Einsatz von anderen Ionischen Flüssigkeiten oder speziell für die Abscheidung von Refraktärmetallen synthetisierter Ausgangsmaterialien notwendig sein.
Danksagung
Der Forscherverbund GALACTIF (Neue galvanotechnische Beschichtungsprozesse aus ionischen Flüssigkeiten; nähere Informationen unter www.galactif.de) ist ein vom Bundesministerium für Bildung und Forschung (BMBF) gefördertes Gemeinschaftsprojekt von sechs deutschen Universitäten und Forschungseinrichtungen im Rahmen der Fördermaßnahme Innovative Elektrochemie mit neuen Materialien (InnoEmat). In diesem Vorhaben wird die elektrochemische Abscheidung von ausgewählten Metall- und Legierungsschichten aus Ionischen Flüssigkeiten untersucht. Es werden grundlegend neue Konzepte erforscht, um eine kostengünstige und umweltfreundliche Beschichtungstechnologie zu entwickeln.
Die Autoren bedanken sich bei den Projektpartnern des Konsortiums, der Technischen Universität Clausthal, der Technischen Universität Chemnitz, dem Fraunhofer-Institut für Schicht- und Oberflächentechnik in Braunschweig, dem Forschungsinstitut Edelmetalle und Metallchemie aus Schwäbisch-Gmünd sowie der Technischen Universität München (Koordinator des Vorhabens) für die hervorragende Zusammenarbeit. Außerdem gilt ein besonderer Dank dem BMBF und dem VDI Technologiezentrum für die Förderung und Betreuung des Forscherverbundprojekts GALACTIF.
Literatur
[1] I. L. Shabalin: Ultra-High Temperature Materials I - Carbon (Graphene/Graphite) and Refractory Metals; Springer Netherlands, 2014; doi:10.1007/978-94-007-7587-9
[2] E. Kunze: Korrosion und Korrosionsschutz, Band 1: Einführung und wissenschaftliche Grundlagen; Wiley-VCH Verlag, 2001; doi: 10.1002/9783527625659
[3] H. Prigent, G. Cathelineau: Evaluation of the biocompatibility of titanium-tantalum alloy versus titanium; J. Biomed. Mater. Res. A. 39 (1997), 200–206, doi: 10.1002/(SICI)1097-4636(199802)39:2<200::AID-JBM5>3.0.CO;2-T
[4] Y. Zhou, M. Niinomi, T. Akahori, M. Nakai, H. Fukui: Comparison of Various Properties between Titanium-Tantalum Alloy and Pure Titanium for Biomedical Applications; Mater. Trans. 48 (2007), 380–384, doi: 10.2320/matertrans.48.380
[5] W. T. Elwell, D. F. Wood: Analysis of the New Metals; Anal. New Met. (1966), 134–223; doi: 10.1016/B978-0-08-011803-1.50007-0
[6] Niobium for MRI; Tantalum-Niobium Int. Study Cent., 2018, https://www.tanb.org/images/Niobium for MRI (v_4).pdf
[7] J. Hebda: Niobium alloys and high temperature applications, 2001; https://samario01.cbmm.com.br/cgs/publico/VisualizaArquivoBVPublica.ashx?DOC_Codigo=747
[8] H. Ohno: Electrochemical Aspects of Ionic Liquids; 2nd edition, John Wiley & Sons, Hoboken, New Jersey, 2011, doi:10.1002/0471762512
[9] R. Böttcher, A. Valitova, A. Ispas, A. Bund: Electrodeposition of aluminium from ionic liquids on high strength steel; Trans. Inst. Met. Finish. 97 (2019), 82–88, doi: doi.org/10.1080/00202967.2019.1573941
[10] F. J. Hernández-Fernández, J. Bayo, A. P. de los Ríos, M. A. Vicente, F. J. Bernal, J. Quesada-Medina: Discovering less toxic ionic liquids by using the Microtox® toxicity test; Ecotoxicol. Environ. Saf. 116 (2015), 29–33, doi: https://doi.org/10.1016/j.ecoenv.2015.02.034
[11] R. F. M. Frade, A. A. Rosatella, C. S. Marques, L. C. Branco, P. S. Kulkarni, N. M. M. Mateus, C. A. M. Afonso, C. M. M. Duarte: Toxicological evaluation on human colon carcinoma cell line (CaCo-2) of ionic liquids based on imidazolium, guanidinium, ammonium, phosphonium, pyridinium and pyrrolidinium cations; Green Chem. 11 (2009), 1660; doi: 10.1039/b914284n
[12] www.linkedin.com/pulse/reach-registration-emim-oac-perfect-ionic-liquid-biomass-ludwig, (n.d.)
[13] F. Endres, D. MacFarlane, A. Abbott: Electrodeposition from Ionic Liquids; Wiley-VCH Verlag, Weinheim, 2008, doi: 10.1002/9783527682706
[14] S. Krischok, A. Ispas, Zühlsdorff, A. Ulbrich, A. Bund, F. Endres: Ta and Nb Electrodeposition from Ionic Liquids; ECS Trans. 50 (2012), 229–237; doi: 10.1149/05011.0229
[15] F. Endres, S. Zein El Abedin, A. Y. Saad, E. M. Moustafa, N. Borissenko, W. E. Price, G. G. Wallace, D. R. MacFarlane, P. J. Newman, A. Bund: On the electrodeposition of titanium in ionic liquids; Phys. Chem. Chem. Phys. 10 (2008), 2189–2199, doi: 10.1039/b800353j
[16] N. Borisenko, A. Ispas, E. Zschippang, Q. Liu, S. Zein El Abedin, A. Bund, F. Endres: In situ STM and EQCM studies of tantalum electrodeposition from TaF5 in the air- and water-stable ionic liquid 1-butyl-1-methylpyrrolidinium bis(trifluoromethylsulfonyl)amide; Electrochim. Acta. 54 (2009), 1519–1528, doi: 10.1016/j.electacta.2008.09.042
[17] Empa, www.empa.ch/de/web/s604/mm-dlc; aufgerufen am 25.3.2019
[18] Nanyang Technological University, http://sc3dp.ntu.edu.sg/Research/Documents/Titanium-tantalum%201.png; aufgerufen am 25.3.2019
[19] firmetal, www.firmetal.com/images/nb-ti-superconductor.jpg; aufgerufen am 3.3.2019
[20] south-tantalum, www.south-tantalum.com/images/Energy-industry.jpg; aufgerufen am 3.3.2019
DOI: