Keramische Membranen aus anodisiertem Aluminiumoxid haben ein sehr breites Einsatzgebiet, da sie neben der Härte, die alle Keramiken kennzeichnet, viele weitere Vorteile mit sich bringen. Die Morphologie der nanoporösen Aluminiumoxidschichten kann relativ einfach durch das Anodisierverfahren gezielt eingestellt werden. Dieses ermöglicht die Herstellung von Membranen mit definierten Porengrößen und Dicken. Darüber hinaus lassen sich die Membranen chemisch modifizieren. Sie können daher neben einer definiert geometrischen auch eine definierte chemische Wechselwirkung eingehen. Ein großer Nachteil liegt jedoch in der Sprödigkeit und der fehlenden Flexibilität der Membran. Die Flexibilität ist jedoch notwendig, um die Membranen später als Separatoren in Batteriezellen einsetzen zu können. Dieser Beitrag stellt das Vorgehen zur Entwicklung einer keramischen, nanostrukturierten Aluminiumoxidmembran über den Prozess der anodischen Oxidation vor. Dabei ist es gelungen, eine vergleichsweise hohe mechanische Stabilität, Flexibilität und Bruchbeständigkeit zu erreichen.
Ceramic membranes of anodised alumina offer a wide range of applications due to their advantageous properties. Typical for all ceramic materials is their hardness. The morphology of nanoporous alumina can be also easily adjusted by customising of the anodising process. This allows the membranes to be produced with defined pore size and layer thickness. The alumina layers can easily be chemically modified, and therefore they interact both in a geometrical and chemical manner. Yet, alumina membranes generally are brittle and not flexible. For later use as a separator for battery cells, it is necessary to improve their mechanical flexibility. This work presents the approach towards the development of a ceramic, nanoporous membrane of aluminium oxide via an anodising process. It was possible to achieve a comparably high mechanical stability, flexibility and fracture resistance.
1 Einleitung
Auf der Oberfläche von reinem Aluminium bildet sich bekanntermaßen sofort nach Exposition an Luft oder Wasser eine natürliche Oxidschicht. Sie erreicht nach einem Tag bei Raumtemperatur eine Dicke von 2 nm bis 3 nm [1] und kann anschließend unter diesen Bedingungen auf Werte von 5 nm bis 10 nm [2] anwachsen. Diese dünne, dichte Schicht wirkt als Schutzbarriere für das Grundmaterial gegenüber schädlichen Einflüssen von außen. Die Wirkung ist allerdings aufgrund der geringen Oxidschichtstärke begrenzt.
Diese dünne, natürliche Oxidschicht kann künstlich durch den Prozess des Anodisierens verstärkt werden. Je nach Betriebsbedingungen können Oxidschichten erzeugt werden, die bis zu 200 000-fach dicker als die natürliche Oxidschicht sind [3]. So modifizierte Aluminiumbauteile sind für ein breites Anwendungsspektrum geeignet. Dabei spielen sowohl funktionale Eigenschaften wie Korrosions- und Verschleißschutz als auch dekorative Aspekte eine Rolle, welche auf der Möglichkeit basieren, Farbstoffe in die Porenstruktur der Schicht einzulagern [4, 5].
Darüber hinaus ist es möglich, aus den anodisierten Aluminiumoxidschichten (AAO-Schichten) keramische Membranen herzustellen. Diese können sowohl in der Biomedizin, beispielweise für das Immobilisieren von Enzymen [6] und als Drug-Delivery-Kapseln [7], oder auch in der Energiebranche, zum Beispiel in der Solarzellen- [8] oder der Batterietechnologie [9, 10], eingesetzt werden. Des Weiteren stehen sie im Fokus der Nanowissenschaftler, da sie eine relativ günstige und einfache Alternative zur Herstellung von Nanomaterialien [11–13] durch den Prozess der Selbstorganisation darstellen.
Am Forschungsinstitut für Innovative Oberflächen FINO wurden im Rahmen des vom BMWi geförderten Projekts Entwicklung einer Li/S-Zelle mit 3D-Zellkomponenten Aluminiumoxid-Membranen entwickelt. Ziel war es, diese als Separatoren in neuartigen Lithium/Schwefel-Batteriezellen (Li/S-Batteriezellen) in Kombination mit schaumbasierten Kathoden [14] und Anoden [15] einzusetzen.
Es ist notwendig, einen mechanisch stabilen und gleichzeitig einen mit einer gewissen Flexibilität ausgestatteten Separator zu verwenden, der dem unregelmäßigen Druck der dreidimensionalen Elektroden widerstehen kann. Des Weiteren muss der Separator die Standardanforderungen, wie beispielweise eine gute Benetzbarkeit mit dem Batterieelektrolyten sowie eine hohe Ionenleitfähigkeit, erfüllen, wobei das Separatormaterial selbst elektrisch isolierend sein muss. Die im Rahmen dieser Arbeit hergestellten Aluminiumoxidschicht-Membranen erfüllen all diese Anforderungen und lassen sich darüber hinaus noch chemisch oberflächenmodifizieren, wodurch ein speziell für Li/S-Zellen wichtiger Rückhalt von Polysulfiden ermöglicht werden soll.
2 Grundlagen des Anodisierens
Das Anodisieren wird in breitem Umfang mit Aluminium durchgeführt; es ist jedoch auch möglich, den Prozess bei anderen Leichtmetallen, wie Titan oder Magnesium, einzusetzen [5]. Dieses Verfahren, auch anodische Oxidation genannt, findet an der Anode einer elektrochemischen Zelle statt. Dort wird das Aluminium durch den Entzug von Elektronen unter Bildung von Aluminiumoxid oxidiert [16]. Die zugrunde liegende Reaktion lautet:
2Al + 9H2O → Al2O3 + 6H3O+ + 6e-[17]
An der Kathode werden dagegen formal die an der Anode entstehenden Oxoniumionen zu Wasserstoff reduziert:
6H3O+ + 6e- → 3H2↑ +6H2O[17]
Es handelt sich um eine elektrochemische Konversionsschicht mit der vereinfachten chemischen Formel Al2O3, wobei ein Schichtbestandteil aus dem Grundmaterial (Aluminium) und der andere Schichtbestandteil (Sauerstoff) aus dem Elektrolyten stammt. Die Schicht wächst dadurch zum Teil in das Bauteil hinein, gleichzeitig durch Einlagerung von Elektroytbestandteilen auch aus dem Bauteil heraus. Insgesamt kommt es so zu einer sehr guten Anhaftung auf dem Grundmaterial [4, 13].
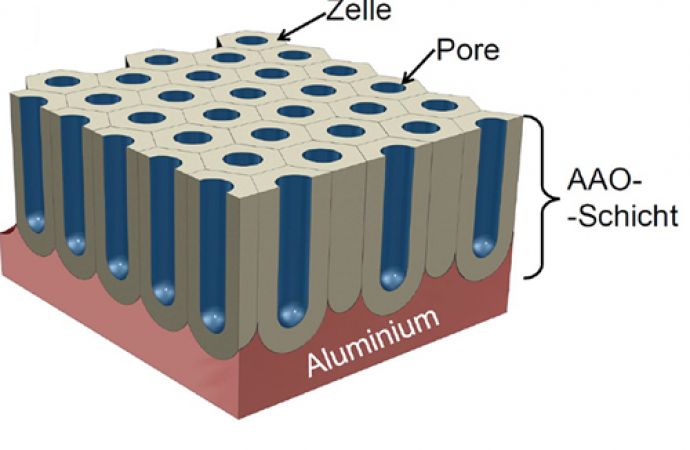
Es ist möglich, sowohl kompakte, dielektrische als auch poröse Schichten herzustellen, wobei in dieser Arbeit nur poröse behandelt werden. Der Aufbau einer solchen Aluminiumoxidschicht aus zwei Teilschichten ist in Abbildung 1 dargestellt. Die untere Schicht, die im Kontakt mit dem Substrat – Aluminium – steht, ist dünn, dielektrisch und wird als Sperrschicht bezeichnet. Die obere, dickere, poröse Deckschicht besteht, idealisiert betrachtet, aus parallelen Nanoporen, eingebettet in hexagonale, bienenwabenähnliche Zellen. Die jeweiligen Schichtdicken und die Porenstruktur sowie die mechanischen Eigenschaften des anodisierten Aluminiumoxids hängen sowohl von der Zusammensetzung des Elektrolyten als auch von den Verfahrensbedingungen ab [3, 18].

Abb. 1: Schematische Darstellung des porösen anodisierten Aluminiumoxids auf einem Aluminiumsubstrat mit einer hexagonalen, bienenwabenähnlichen Zelle (a) und einer runden Pore (a) als Querschnitt mit markiertem Aluminiumsubstrat, dielektrischer Sperrschicht sowie poröser Aluminiumoxidschicht (b); tb - Dicke der Sperrschicht, tw - Dicke der Wand der Pore, lp - Porenlänge, Dp - Durchmesser der Pore, Dint - Abstand zwischen den Poren
Wie beschrieben, ist es möglich, aus substratgebundenen Aluminiumoxidschichten freistehende keramische Membranen herzustellen. Für diesen Zweck werden in der Regel poröse Schichten genutzt. Dabei wird nach dem Anodisiervorgang das verbliebene Aluminiumsubstrat durch chemische Auflösung entfernt. Als weiterer Schritt wird die Sperrschicht aufgelöst, wodurch die Poren geöffnet werden. Die erhaltenen freistehenden Membranen aus Aluminiumoxid sind relativ hart, dabei oft auch sehr spröde und nicht flexibel. Vorteilhaft ist die Möglichkeit des Einstellens der Membranparameter durch Anpassung des Anodisierverfahrens. In nachfolgenden Schritten können die Membranen relativ einfach chemisch funktionalisiert werden. Auf der Membranoberfläche befinden sich Hydroxylgruppen, die leicht modifiziert und damit mit gewünschten Eigenschaften ausgestattet werden können [19].
Die Reinheit sowie die Vorbehandlung des Substrats spielen für die Morphologie und die Eigenschaften der Schicht eine beträchtliche Rolle. Da die Aluminiumoxidschicht teilweise aus dem Grundmaterial gebildet wird und Legierungsbestandteile beziehungsweise Verunreinigungen in der Regel im Anodisierprozess nicht mit umgesetzt werden, gehen diese in die Anodisierschicht über. Hierbei entstehen häufig auch Schichtfehler, zum Beispiel in Form einer gestörten Porenanordnung. Durch eine geeignete Vorbehandlung können Oberflächendefekte, die zum Beispiel durch das Walzen oder die Lagerung des Aluminiums entstanden sind, beseitigt werden. Hierfür können neben mechanischen auch chemische und elektrochemische Methoden eingesetzt werden.
Ein weiterer wichtiger Faktor für die Membranparameter ist die Wahl des Elektrolyten. Die am häufigsten eingesetzten Elektrolyte für die Herstellung von porösen Schichten sind Lösungen auf Basis von Schwefel-, Oxal-, Phosphor- oder Chromsäure [13]. Wichtige Prozessparameter sind die Umwälzung des Elektrolyten während des Prozesses, das gewählte Stromprogramm (Gleich- oder Pulsstrom), angelegter Strom beziehungsweise angelegte Spannung sowie Prozessdauer und -temperatur. Durch die Nachbehandlung zur Porenerweiterung beziehungsweise die Nachbehandlung zum Entfernen des restlichen Aluminiums und der Sperrschicht bei der Herstellung von Membranen können die Morphologie sowie die Eigenschaften des Aluminiumoxids ebenfalls signifikant verändern werden.
Im Fall eines potentiostatisch kontrollierten Prozesses steigen die Porendurchmesser mit der Erhöhung des Potentials und der Elektrolytkonzentration an. Die Verlängerung der Anodisations- sowie erweiterten Auslagerungszeit als auch die Erniedrigung des pH-Werts des Elektrolyten haben denselben
Effekt [13].
3 Experimentelles
Für die Herstellung der Membranen aus einer anodisch erzeugten Aluminiumoxidschicht wird eine speziell für diesen Zweck entwickelte Anodisierzelle (Abb. 2a) sowie ein temperierbares Doppelwandglasgefäß (Abb. 2b) eingesetzt.

Abb. 2: Schema der Anodisierzelle (a) mit Temperaturfühler (1), Welle mit Propeller (2), Kathode mit Kontaktierung (3), PVC-Halterung (4), Aluminiumsubstrat (grün; 5), Schutzplatte aus Aluminium (blau; 6) und Kupfer-Grundplatte mit Kühlwendel und Kontaktierung der Anode (7); Teilbild b zeigt das temperierbare Doppelwand-Glasgefäß mit Temperaturfühler (A), Doppelwandglasgefäß mit Kühlmittel (B), Anode (C), Kathode (D), Elektrolyt (E) und Magnetrührstäbchen (F)
Alle Versuche werden in wässrigen Oxalsäureelektrolyten mit der Konzentration von 0,4 mol/L beziehungsweise 1 mol/L ohne weitere Zusätze durchgeführt. Das Anodisieren erfolgt primär unter galvanostatischen Bedingungen mit einer angewandten Strom-dichte zwischen 1,0 mA/cm2 und 36,0 mA/cm2. Unter potentiostatischen Bedingungen wird der Spannungsbereich zwischen 40 V und 70 V untersucht. Die Anodisierdauer (15 min bis 7 h) sowie die Prozesstemperatur (0 °C bis 40 °C) werden variiert. Als Substrat wird eine Aluminiumfolie mit einer Reinheit von 99,5 % (EN AW-1050A nach DIN 573-3, AluJet) eingesetzt. Zusätzlich wird der Einfluss der Vorbehandlung des Substrats auf die entstandenen Schichten untersucht. Für die Vorbehandlung werden unterschiedliche Methoden eingesetzt: mechanisches Glätten, Reinigung in Aceton und Isopropanol, Beizen, Elektropolieren (Lösung aus 60 % Perchlorsäure und Ethanol 1:4 (vol/vol), ϑ = 5 °C bis 10 °C, U = 15 V, t = 3 min) und Glühen (ϑ = 400 °C, t = 4 h, unter Argon-Schutzatmosphäre).
Nach dem Anodisieren wird das Restaluminium durch Eintauchen in konzentrierte Salzsäure aufgelöst. Das Porenöffnen zum Entfernen der Sperrschicht erfolgt durch Behandlung mit Phosphorsäure (8 Gew.% bis 23 Gew.%) für 30 min bis 180 min.
Für die Charakterisierung der Membran wird primär mit einem Rasterelektronenmikroskop (Modell Gemini 1525, Carl Zeiss, Oberkochen) gearbeitet. Die Proben werden nicht besputtert, die Beschleunigungsspannung liegt in der Regel bei 1 kV.
4 Ergebnisse und Diskussion
Um eine ausreichende mechanische Stabilität mit einer gewissen Flexibilität zu verbinden, wird eine Membrandicke von 60 µm bis 100 µm angestrebt. Aus diesem Grund werden Aluminiumfolien mit einer Stärke von 100 µm als Ausgangsmaterial eingesetzt. Wird das Substrat in die Elektrolytlösung getaucht und anodisiert, wächst die Oxidschicht von beiden Folienseiten, wodurch die Porenbildung mit durchgängigen Kanälen erschwert ist. Wird nur einseitig anodisiert, kann die Nachbehandlung wie oben beschrieben durch Auflösung des Restaluminiums und Öffnen der Sperrschicht vereinfacht durchgeführt werden. Um zu garantieren, dass die Folie nur einseitig mit Elektrolyt in Kontakt kommt, ist die Verwendung eines speziellen Versuchsaufbaus erforderlich (Abb. 2a). Das Foliensubstrat liegt zu diesem Zweck auf einer Kupferkühlplatte mit einer Aluminiumschutzplatte als Zwischenschicht. Die Kontaktierung der Anode erfolgt über die Kupferplatte. In der Zelle ist es möglich, Folien mit einem Durchmesser von etwa 140 mm großflächig zu anodisieren (Gesamtdurchmesser des Substrates: 160 mm). Abbildung 3 zeigt ein im Rahmen der Untersuchungen anodisiertes Aluminiumsubstrat.

Abb. 3: Aluminiumfolie nach dem Anodisieren in der Anodisierzelle, wobei der dunkelgraue Bereich die hergestellte Aluminiumoxidschicht darstellt
Die Vorversuche zur Ermittlung der Prozessparameter wurden zunächst in einem temperierbaren Doppelwandgefäß durchgeführt. Diese Versuche dienten primär der Charakterisierung der Struktur der Aluminiumoxidschichten.
Als Elektrolyt werden Oxalsäurelösungen eingesetzt. Als Stand der Technik wird das Gleichstrom-Schwefelsäure-Verfahren bevorzugt angewendet [20]. Auf der Basis der Vorversuche wurde festgestellt, dass die Morphologie der Aluminiumoxidschichten aus Oxalsäureelektrolyten besser die Anforderungen an den zukünftigen Einsatz als Batterieseparator erfüllen als diejenigen Schichten aus Schwefelsäureelektrolyten. Oxalsäureelektrolyte werden auch in der Literatur zur Herstellung von Membranen beschrieben [9, 10].
Anhand der Vorversuche wurden folgende Prozessparameter ermittelt:
- Elektrolytkonzentration: cE = 0,4 mol/L
- Elektrolyttemperatur: ϑE = 20 °C
- Stromdichte: i = 6 mA/cm2
- Prozesszeit: tP = 7 h
Abbildung 4 zeigt den Spannungsverlauf während des Prozesses unter galvanostatischen Bedingungen im Zusammenhang mit der Temperatur des Elektrolyten und des Kühlmediums. Die Spannung steigt zu Beginn des Prozesses rasch auf etwa 60 V an, um nach kurzer Zeit wieder auf etwa 50 V abzufallen. Mit fortschreitender Prozessdauer steigt die Spannung kontinuierlich bis zum Ende des Experiments auf etwa 105 V an. Zunächst erhöht sich die Temperatur des Elektrolyten kurzzeitig auf etwa 24 °C, bevor sich der Wert für die restliche Versuchsdauer auf 20 °C stabilisiert. Bemerkenswert ist der Temperaturabfall des Kühlmediums, der etwa ab der zweiten Stunde der Prozessdauer zu erkennen ist. Der Abfall korreliert mit der steigenden Spannung und spiegelt die benötigte Leistungssteigerung des Kühlaggregats wieder.

Abb. 4: Verlauf der Spannung während des Anodisierens unter galvanostatischen Bedingungen in Zusammenhang mit der Temperatur des Elektrolyten und des Kühlmediums

Abb. 5: Anodisch erzeugte Aluminiumoxidschicht im Querschliff; erkennbar sind die Aluminiumoxidschicht (A) sowie das verbliebene Aluminiumsubstrat (B) (1000-fache Vergrößerung)
Bei Betrachtung des Querschliffs (Abb. 5) mittels Rasterelektronenmikroskop ist zu erkennen, dass die Dicke der erzeugten Aluminiumoxidschicht (A) bei 72 µm liegt. Damit wird die Vorgabe bezüglich der Oxidschichtdicke erfüllt. Die Dicke des verbliebenen Aluminiumsubstrats (B) liegt gemäß der Abbildung bei etwa 23 µm.
Die Porenstruktur lässt sich gut an der Bruchkante des Aluminiumsubstrats erkennen. Abbildung 6a zeigt eine seitliche Ansicht der Schichtstruktur mit der dem Elektrolyt zugewandten Folienseite. Entlang der Bruchkante sind die parallel zueinander ausgerichteten Porenkanäle zu sehen. Im oberen Teil der Aufnahme werden die Porenkanäle aufgrund eines Versatzes unterbrochen, wodurch ein Teil der Porenstrukturen sichtbar wird. Eine Stelle im mittleren Bereich zwischen Porenseite und Sperrschicht der untersuchten Aluminiumoxidschicht ist in Abbildung 6b zu sehen. Neben den parallel zueinander laufenden Porenkanälen ist der Bereich im mittleren Teil der Probe interessant. Der Porenverlauf ist dort aufgrund von zwei Defekten (A und B) gestört. Die Porenkanäle laufen nicht durch diesen Bereich hindurch, sondern umwandern ihn. Gleiches ist im unteren rechten Bereich (C) der Abbildung zu erkennen. Es kann sich um Porenstrukturdefekte durch Verwendung des 99,5-%igen Aluminiumsubstrats und damit um Fremdphasen handeln, die im nicht hochreinem Substrat enthalten sind. Bei 20 000-facher Vergrößerung werden Porenverzweigungen sichtbar (Abb. 6c). Die Porenkanäle in den markierten Bereichen (1, 2, 3) teilen sich im Verlauf in weitere Kanäle auf. Bei der Betrachtung der Grenzschicht zwischen Aluminiumsubstrat und Aluminiumoxid, wie sie in Abbildung 6d zu sehen ist, ist neben den parallel zueinander angeordneten Porenkanälen (I) die Sperrschicht (II) zu erkennen. Die Grenzschicht der Aluminiumoxidphase (III) besitzt eine gekrümmte Struktur.

Abb. 6: Porenstruktur der Aluminiumoxidschicht in unterschiedlichen Ansichten; von der Seite der geöffneten Poren (a, 10 000-fache Vergrößerung), im mittleren Bereich mit markierten Defekten (A, B, C) (b, 7000-fache Vergrößerung), im mittleren Bereich mit markierten Porenverzweigungen (1, 2, 3), (c, 20 000-fache Vergrößerung) sowie Sperrschicht im Übergang zum Aluminiumsubstrat mit Porenkanälen (I), Sperrschicht (II), Aluminiumoxid (III) und Aluminium (IV) (d, 25 000-fache Vergrößerung)

Abb. 7: Anodisch hergestellte Aluminiumoxidschicht nach dem Ätzen in konzentrierter Salzsäure von der Porenseite (a) sowie von der Sperrschichtseite (b) in 80 000-facher Vergrößerung
Nach dem Prozess der anodischen Oxidation wird das überschüssige Aluminiumsubstrat in konzentrierter Salzsäure selektiv aufgelöst. Dadurch wird erstmals die Struktur des Porenbodens der Aluminiumoxid-Sperrschicht sichtbar. Der Durchmesser der halbkugelförmigen geschlossenen Porenböden ist mit etwa 150 nm im Vergleich zum Durchmesser der Poren auf der Porenseite (ca. 50 nm) um den Faktor drei größer (Abb. 7a und 7b). Nicht nur der Durchmesser der Poren ist unterschiedlich, auch die Abstände zwischen den Poren sind auf der Seite der Sperrschicht deutlich größer. Das weist darauf hin, dass die Porendichte der Schicht im Laufe des Prozesses Veränderungen unterliegt.
Die Unterschiede der Porendichte zwischen Porenseite und Sperrschicht lassen sich nach dem Modell von Masuda und Fukuda [21] durch eine Zunahme der Selbstordnung während des Prozesses begründen. Das Porenwachstum beginnt demzufolge ungeordnet an der Substratoberfläche. Mit fortschreitendem Wachstum blockieren sich eng benachbarte Poren gegenseitig. Dadurch kann das Wachstum einiger Poren unterbrochen werden und der Ordnungsgrad der Poren nimmt zu. Des Weiteren kann ein Zusammenwachsen von zwei oder mehreren Kanäle zu einem einzelnen Porenkanal auftreten (Abb. 6c), was letztendlich ebenfalls zur Steigerung des Ordnungsgrades und zur Reduzierung der Porenkanäle beiträgt. Infolgedessen ist die Porendichte an der Oberfläche der Porenseite höher als an der Sperrschichtseite der Aluminiumoxidschicht.
In Abbildung 7a sind zudem relativ viele Defekte der Struktur, die sich als stark ausgeprägte Kanten und Unebenheiten sowie Löcher auf der Oberfläche zeigen, sichtbar. Sie können zum einen die Folge der Anwesenheit von Fremdphasen im Aluminiumsubstrat sein. Zum anderen wurde im Laufe der Versuche zur Vorbehandlung des Substrats vor dem Anodisieren festgestellt, dass diese einen großen Einfluss auf die später hergestellten Aluminiumoxidschichten hat. Durch Elektropolieren können die Oberflächendefekte signifikant reduziert werden. Im Hinblick auf eine spätere kommerzielle Nutzung des Prozesses wurde als bevorzugte Vorbehandlungsmethode die Reinigung mit Aceton und Isopropanol untersucht.
Nach dem Entfernen des Aluminiums verbleibt eine gelbliche, halbtransparente, keramische Membran. Diese erweist sich, trotz einer gewissen Sprödigkeit, als mechanisch stabil und flexibel. Eine solche flexible, gebogene und durch Anodisieren hergestellte Aluminiumoxidmembran ist in Abbildung 8 zu sehen. Die keramische Membran mit einem Durchmesser von etwa 140 mm kann stark gebogen werden, ohne eine mechanische Schädigung zu erleiden. Nach dem Entspannen kehrt der Film vollständig in seine Ausgangsform zurück.

Abb. 8: Manuell gebogene, freistehende Aluminiumoxidmembran vor dem Öffnen der Sperrschicht
Darüber hinaus wurde der Prozess des Porenöffnens – des Entfernens der Sperrschicht – untersucht und erfolgreich in einer Phosphorsäurelösung durchgeführt. Dadurch ist es gelungen, eine freistehende Membran herzustellen. Dieser Schritt wird in der Literatur als einer der schwierigsten Prozesse bei der Herstellung einer vollständig geöffneten Aluminiumoxidmembran beschrieben [22]. Eine detaillierte Beschreibung dieses Prozesses sowie der Ergebnisse ist im Rahmen eines weiteren Beitrags geplant.
5 Zusammenfassung
Am FINO wurde erfolgreich ein Prozess zur Herstellung einer freistehenden, keramischen Membran aus anodisiertem Aluminiumoxid entwickelt. So hergestellte Membranen können langfristig als Separatoren in innovativen Lithium/Schwefel-Zellen eingesetzt werden. Durch die Entwicklung eine Anodisierzelle mit Kühlplatte, welche eine exakte Temperaturregulierung direkt am Substrat erlaubt, ist es möglich, mechanisch hoch flexible Aluminiumoxid-Membranen auf Basis kostengünstiger, da nicht hochreiner Ausgangsmaterialien zu erzeugen. Neben der Darstellung des praktischen Vorgehens wurden auch die dem Prozess zugrundeliegenden Mechanismen untersucht und erläutert.
Danksagung
Die hier vorgestellten Ergebnisse wurden im Rahmen von zwei Research-Master-Arbeiten, welche im Zuge der Projektarbeit zur Entwicklung einer Li/S-Zelle mit 3D-Zellkomponenten für eine gesteigerte Energieeffizienz, Zyklenfestigkeit und Sicherheit angefertigt wurden, erarbeitet. Das IGF-Vorhaben 19134 N der Forschungsvereinigung Edelmetalle+Metallchemie wird über die AiF im Rahmen des Programms zur Förderung der Industriellen Gemeinschaftsforschung (IGF) vom Bundesministerium für Wirtschaft und Energie aufgrund eines Beschlusses des Deutschen Bundestags gefördert.
DOI: 10.7395/2020/Komorowska1
Literatur
[1] S. Wernick, R. Pinner, P.G. Sheasby: The surface treatment and finishing of aluminium and its alloys; 5. Aufl., Finishing, Teddington, 1987
[2] A. Vollmer, M. Habermeyer, H. Sitzmann, E. Schwab: Aluminium; zu finden unter https://roempp.thieme.de/lexicon/RD-01-01786, 2020
[3] F. Ostermann: Anwendungstechnologie Aluminium; Springer Berlin Heidelberg, Berlin/Heidelberg, 2014
[4] Max Schenk: Werkstoff Aluminium und seine Anodische Oxydation. Ein Handbuch und Ratgeber für den Praktiker; A. Francke AG. Verlag Bern, 1948
[5] H. Dong (Hrsg.): Woodhead Publishing in materials; Woodhead Pub, Oxford, UK, 2010
[6] M. Darder, P. Aranda, M. Hernández-Vélez, E. Manova, E. Ruiz-Hitzky; Thin Solid Films (2006) 495, 321
[7] D. Gong, V. Yadavalli, M. Paulose, M. Pishko, C. A. Grimes, Biomedical Microdevices 2003, 5, S. 75
[8] W. A. El-Said, M. Abdel-Shakour, A. M. Abd-Elnaiem; Materials Letters (2018) 222, S. 126
[9] A. Mozalev, S. Magaino, H. Imai; Electrochimica Acta (2001) 46, S. 2825
[10] J. Chen, S. Wang, L. Ding, Y. Jiang, H. Wang; Journal of Membrane Science (2014) 461, S. 22
[11] G. D. Sulka, W. J. Stępniowski; Electrochimica Acta (2009) 54, S. 3683
[12] G. E. J. Poinern, N. Ali, D. Fawcett; Materials, Basel, Switzerland, (2011) 4, S. 487
[13] A. Eftekhari (Hrsg.): Nanostructured materials in electrochemistry; Wiley-VCH, Weinheim, Chichester, 2008
[14] Ş. Sörgel, O. Kesten, A. Wengel, T. Sörgel; Energy Storage Materials (2018) 10, S. 223
[15] Ş. Sörgel; JEPT - Journal for Electrochemistry and Plating Technology (2018) 06.06.2018
[16] W. Ensinger: Anodische Oxidation; zu finden unter https://roempp.thieme.de/lexicon/RD-01-02580, 2020
[17] Andreas Rudolf Lotz, Dissertation, Justus-Liebig-Universität, Gießen, 2009
[18] W. Lee, S.-J. Park; Chemical reviews (2014) 114, S. 7487
[19] A. M. Md Jani, D. Losic, N. H. Voelcker; Progress in Materials Science (2013) 58, S. 636
[20] W. Hübner, C. T. Speiser: Die Praxis der anodischen Oxidation des Aluminiums; 4. Aufl., Aluminium-Verlag, Düsseldorf, 1988
[21] H. Masuda, K. Fukuda; Science (1995) 268, S. 1466
[22] J. J. Schneider, J. Engstler, K. P. Budna, C. Teichert, S. Franzka; Eur. J. Inorg. Chem. (2005) 2005, S. 2352
- https://www.hs-aalen.de/de/facilities/91