Atmosphärendruckplasmen lassen sich mit relativ geringem Aufwand zum Einsatz an kleineren Oberflächen auch in biologischen Systemen anpassen. Damit ist gerätetechnisch die Anwendung in der Medizin möglich. Mittels Plasma lassen sich Viren effektiv inaktivieren. Dies erfolgt vor allem durch die Wirkung kurzlebiger, oxidativ wirksamer Spezies, die im Plasma gebildet werden. Durch eine gezielte Anpassung der Behandlungsstrategie kann die antivirale Wirkung optimiert und gleichzeitig das Risiko minimiert werden.
In der Plasmamedizin wird die Wirkung von kaltem Atmosphärendruckplasma für therapeutische Zwecke genutzt. Atmosphärendruckplasmaquellen sind in Kliniken bereits zur Behandlung chronischer Wunden und erregerinduzierter Hauterkrankungen etabliert. Umfassend nachgewiesen ist eine antimikrobielle Aktivität von kalten Atmosphärendruckplasmen, die unter anderem auf unterschiedliche reaktive Sauerstoff- und Stickstoffspezies (RONS) zurückzuführen ist. Außerdem können Plasmen für die Inaktivierung von Viren auf Oberflächen geeignet sein. Das Potential dieser Technologie zum passiven und aktiven Schutz vor viralen Atemwegsinfektionen ist bislang aber weder vollständig erkannt noch ausgeschöpft; um diese Situation zu verbessern, wurde von den Autoren eine Studie [1] durchgeführt, aus der hier einige der gewonnenen Erkenntnisse zusammengefasst werden.
Durch eine konsequente Miniaturisierung können Plasmajets so ausgelegt werden, dass sie auch für eine direkte Anwendung auf der Schleimhaut des Mund-Nasen-Rachenraums geeignet sind. Abbildung 1 zeigt einen schlauchförmigen Neon-Plasmajet mit einem Außendurchmesser von nur 1,8 mm. Bei der verwendeten Quelle für das Atmosphärendruckplasma handelt es sich um einen von den Autoren hergestellten experimentellen Aufbau. Verschiedene Hersteller bieten derzeit auch kommerzielle Systeme an, die insbesondere für dermatologische Anwendungen vorgesehen sind.

Abb. 1: Miniaturisierter Atmosphärendruck-Plasmajet, modifiziert nach Mrochen et al. [1]

Abb. 2: Konzentration der RONS in phosphatgepufferter Salzlösung nach Plasmabehandlung, modifiziert nach Mrochen et al. [1]
Der Eintrag von RONS in phosphatgepufferte Salzlösung durch die Behandlung mit diesem Plasmasystem wurde nachgewiesen, wobei bei einem Behandlungsabstand von 3 mm der sichtbare Effluent des Plasmajets die Flüssigkeitsoberfläche berührt und den Spezieseintrag deutlich erhöht (Abb. 2). Wird der Behandlungsabstand vergrößert, so dass zwischen Effluent und Flüssigkeit ein Luftspalt bleibt, verringert sich die gebildete RONS-Konzentration deutlich, wie am Beispiel von Wasserstoffperoxid (H2O2) erkennbar ist [1].
Mit dem Plasmasystem wurde eine Suspension von murinen Hepatitis-Viren (MHV), einem Vertreter der Corona-Viren, behandelt. Daraufhin wurden Maus-Fibroblasten mit den in der Suspension befindlichen Viren infiziert. Gemessen an der Anzahl der lysierten Zellen (sog. Plaques) zeigte sich, dass die Plasmabehandlung im Kontakt zwischen Effluent und Flüssigkeitsoberfläche zu einer stark ausgeprägten Reduktion (>90 % bei 3 mm) des Virustiters führt (Abb. 3, links) [1].

Abb. 3: Virustiter nach Behandlung der MHV-Suspension bei unterschiedlichen Behandlungsabständen und teilweiser Zugabe von Antioxidantien (AO) sowie metabolische Aktivität von Maus-Fibroblasten nach Infektion mit der Suspension in Abhängigkeit von der Behandlungszeit durch das Plasma und der Verdünnung der Suspension, modifiziert nach Mrochen et al. [1]
Diese Reduktion war so prominent, dass die metabolische Aktivität von Zellen nach Inaktivierung der Viren durch das Plasma bei längeren Behandlungszeiten ähnlich den Zellen war, die gar nicht mit Viren infiziert wurden (Abb. 3, rechts, 10 s vs. kein Virus). Untersuchungen mit einer Vielzahl unterschiedlicher Antioxidantien, die als gezielte Scavenger für verschiedene kurz- oder längerlebige RONS wirken, zeigten eine herausragende Bedeutung kurzlebiger Spezies für die antivirale Wirkung auf [1].
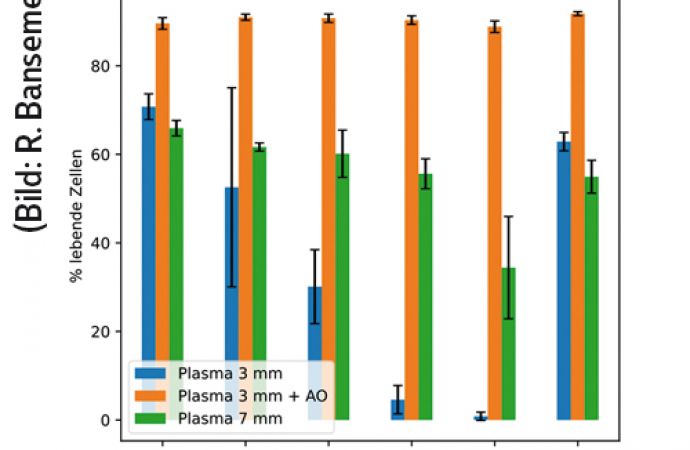
Zusätzlich wurden vier unterschiedliche humane Zelllinien plasmabehandelt, von denen hier zwei beispielhaft gezeigt werden. 18 h später wurde die Vitalität der Zellen untersucht. Abbildung 4 zeigt, dass die verschiedenen Zelllinien unterschiedlich stark auf die Plasmabehandlung reagieren, wobei die Empfindlichkeit im direkten Kontakt zum Plasmaeffluenten (3 mm) höher ist [1].

Abb. 4: Zellviabilität unterschiedlicher humaner Zellen nach Plasmabehandlung, teilweise nach Zugabe von Antioxidantien (AO), modifiziert nach Mrochen et al. [1]
Der teilweise beobachtete Zelltod tritt dabei als Apoptose (genetisch programmierter Zelltod) auf, nie als Nekrose (Absterben von Zellen, Gewebs- oder Organbezirken als pathologische Reaktion auf bestimmte Einwirkungen). Die reduzierte Toxizität der Plasmabehandlung bei Zugabe von Antioxidantien macht deutlich, dass RONS die beobachtete Wirkung des Plasmas vermitteln. Über gezielte Untersuchungen zur Rolle der unterschiedlichen beteiligten Verbindungen konnte hierfür eine dominante Rolle der längerlebigen RONS ermittelt werden [1].
Insgesamt zeigt sich, dass eine Behandlung mit dem untersuchten Plasmajet Corona-
Viren inaktiviert, wobei das Gerät im direkten Kontakt zwischen Plasmaeffluent und Flüssigkeitsoberfläche die beste Wirkung bietet. Auch die Ausbeute an RONS in der behandelten Flüssigkeit ist dann am höchsten, womit eine bedeutende Rolle zumindest einiger dieser Stoffe für die Inaktivierung der Viren bestehen kann. Als konkreter Inaktivierungsmechanismus der im Durchschnitt 86 nm kleinen murinen Hepatitis-Viren ist eine Beschädigung der Lipid-Membran durch bestimmte RONS wahrscheinlich, wurde hier aber nicht näher untersucht [1].
Je nach Behandlungsdauer besteht besonders im direkten Kontakt mit dem Plasmaeffluenten auch ein gewisses Potential zur Induktion zytotoxischer Effekte in bestimmten menschlichen Zelllinien. Für die beobachteten zytotoxischen Effekte sind allerdings vordergründig langlebige durch Plasma generierte Verbindungen wie Wasserstoffperoxid (H2O2) verantwortlich. Die antivirale Wirkung konnte stattdessen auf kurzlebige Verbindungen zurückgeführt werden und wurde auch durch eine Vorbehandlung mit den Antioxidantien (AO) oder antioxidativ wirkenden Enzymen nicht völlig unterdrückt, während die zytotoxische Wirkung in den Zelllinien durch Antioxidantien vermeidbar war [1].
Durch eine gezielte Anpassung der Behandlungsstrategie kann so die antivirale Wirkung optimiert und gleichzeitig das Risiko minimiert werden. Damit ergibt sich ein wirksames und beherrschbares Konzept zur zielgerichteten Entwicklung neuer, wirksamer und sicherer Methoden zur ursächlichen Behandlung von durch Corona-Viren induzierten Erkrankungen. Durch den Einsatz eines miniaturisierten Plasmajets ist auch eine direkte Behandlung im Mund-Nasen-Rachenraum sowie in Kavitäten in diesem Bereich denkbar.
DOI: 10.7395/2023/bansemer1
Hinweis
Der vorliegende Beitrag wurde unter anderem zum Wettbewerb #ZukunftADP des Arbeitskreises Atmosphärendruckplasma 2023 eingereicht. Die Arbeiten werden im Rahmen des Projektes PlasmaplusCorona - Plasmabasierte Desinfektion des Respirationstraktes zur Senkung der SARS-CoV-2-Viruslast in vitro und in vivo vom Bundesministerium für Bildung und Forschung gefördert (Förderkennzeichen 03COV06A).
Literatur
[1] D. M. Mrochen, L. Miebach, H. Skowski, R. Bansemer, C. A. Drechsler, U. Hofmann, M. Hein, U. Mamat, T. Gerling, U. Schaible, T. von Woedtke, S. Bekeschus: Toxicity and virucidal activity of a neon-driven micro plasma jet on eukaryotic cells and a coronavirus; Free Radical Biology and Medicine (2022) 191, S. 105-118
1) ZIK plasmatis, Leibniz-Institut für Plasmaforschung und Technologie e. V.
2) Forschungszentrum Borstel, Leibniz Lungenzentrum